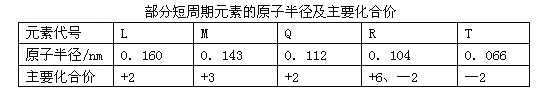
题目内容
【题目】常温下,有KOH和Ca(OH)2的混合溶液,测得其pH=13。取此溶液300 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示,图中V1为224 mL(标准状况),则图中V2、V3的数值(单位为mL)分别是( )
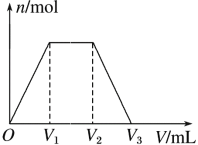
A.336、672 B.448、672
C.1120、1176 D.296、352
【答案】B
【解析】
试题解析:由图分析O→V1, CO2与Ca(OH)2生成CaCO3反应,V1为224 Ml,n(CO2)=0.01mol; n(Ca(OH)2) =0.01 mol; n(KOH)=0.1×0.3-0.01×2=0.01 mol; KOH消耗二氧化碳反应生成碳酸氢钾溶液;V2-V1 =0.01 × 22.4;V2 = V1 + 0.224 = 0.224+0.224=0.448L=448mL;V2—V3过程为CaCO3与CO2、H2O生成Ca(HCO3)2的反应。因此消耗n(CO2)= n(Ca(OH)2)=0.01 mol; V3- V2=0.01×22.4;V3= V2+0.224=0.448+0.224=0.672L=672Ml; 答案B正确;
考点:二氧化碳与混合碱液反应的变化规律。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目