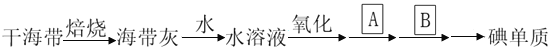题目内容
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g) △H<0。
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为______mol。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是______________。
(3)还可利用ClO2 消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
NO ![]() NO2
NO2  N2
N2
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为_____,反应中若生成22.4L N2(标准状况),则消耗ClO2_____g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
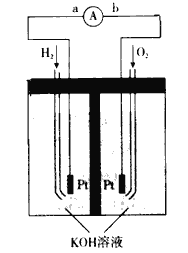
①氢氧燃料电池的能量转化主要形式是_______,工作时电流方向为____(用a、b和箭头表示)。
②负极的电极反应式为________________。
③电极表面镀铂粉的原因为____________。
【答案】> 6 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ·mol﹣1 2NO + ClO2 + H2O = NO2 + HNO3 + HCl 135 化学能→电能 b→a H2﹣2e﹣+2OH﹣=2H2O 增大电极单位面积吸附H2和O2的分子数,增大反应速率
【解析】
(1)①该反应为放热反应;
②由元素化合价的变化可知,该反应中还原剂为NH3,氧化剂为NO和NO2;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、氯化氢以及二氧化氮,反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl,反应生成的NO2与Na2SO3发生氧化还原反应生成氮气和硫酸钠,反应的化学方程式为2NO2+4Na2SO3=N2+4Na2SO4;
(4)该装置是把化学物质中的能量转化为电能,碱性环境中,负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-=2H2O,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,电子的流向是从负极经导线流向正极。
(1)①该反应为放热反应,反应物总能量大于生成物总能量,故答案为:>;
②由化学方程式可知,当该反应有2molN2(g)生成时,反应消耗还原剂NH3的物质的量为2mol,则反应的电子转移的量是2 mol×3=6mol,故答案为:6;
(2)将已知反应依次编号为①②,根据盖斯定律②×2-①可得CH4(g)将NO(g)还原为N2(g)的方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),则△H=[2×(-867kJ/mol)-(-574kJ/mol)]=-1160kJmol-1,故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJmol-1;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、氯化氢以及二氧化氮,由硝酸与NO2物质的量相等可知反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl;反应生成的NO2与Na2SO3发生氧化还原反应生成氮气和硫酸钠,反应的化学方程式为2NO2+4Na2SO3=N2+4Na2SO4,由反应的两个化学方程式可知,ClO2和N2的关系式为:2ClO2~2NO2~N2,标准状况下,反应中生成22.4L N2的物质的量为1mol,则n(ClO2)=2n(N2)=2 mol,m(ClO2)=2mol×67.5g/mol=135g,故答案为:2NO+ClO2+H2O=NO2+HNO3+HCl;135;
(4)①该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极经导线流向正极,所以是由a到b,电流方向为b→a,故答案为:化学能转变为电能;b→a;
②碱性环境中,负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
③电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应速率加快,故答案为:增大电极单位面积吸附H2和O2的分子数,加快电极反应速率。

【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D