题目内容
(15分)在某反应体系中存在六种物质:Cr3+、S2O82-、Cr2O72-、H+、H2O和SO42-。已知在该反应中氧化反应只有Cr3+→Cr2O72-,反应过程中需要Ag+作催化剂,并加热。请回答下列问题:
(1)已知S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为__________价。
(2)写出该反应体系中发生反应的离子方程式:_______________________________。
(3)催化剂往往参加反应,改变反应途径。用两个离子方程式表示Ag+的催化过程:____________________________;________________________。
(4)若将上述反应设计成一个原电池,用石墨作电极,则其负极反应式为:_____________________,正极反应式为:____________________________。
(1)已知S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为__________价。
(2)写出该反应体系中发生反应的离子方程式:_______________________________。
(3)催化剂往往参加反应,改变反应途径。用两个离子方程式表示Ag+的催化过程:____________________________;________________________。
(4)若将上述反应设计成一个原电池,用石墨作电极,则其负极反应式为:_____________________,正极反应式为:____________________________。
(1)+6(2分) (2)2Cr3++3S2O82-+7H2O Cr2O72-+6SO42-+14H+(3分)
Cr2O72-+6SO42-+14H+(3分)
(3)2Cr3++6Ag++7H2O=Cr2O72-+6Ag↓+14H+(2分) 2Ag+S2O82-=2Ag++2SO42-(2分)
(4)2Cr3++7H2O-6e-= Cr2O72-+14H+(3分) 3S2O82-+6e-=6SO42-(3分)
 Cr2O72-+6SO42-+14H+(3分)
Cr2O72-+6SO42-+14H+(3分)(3)2Cr3++6Ag++7H2O=Cr2O72-+6Ag↓+14H+(2分) 2Ag+S2O82-=2Ag++2SO42-(2分)
(4)2Cr3++7H2O-6e-= Cr2O72-+14H+(3分) 3S2O82-+6e-=6SO42-(3分)
(1)过氧键中的两个氧原子均为-1价,其他氧原子均为-2价。据此可计算出S2O82-离子中硫元素的化合价为+6价。(2)根据化合价升降相等和电荷守恒即可完成。
(3)根据催化剂的概念,Ag+的催化过程是:Ag+先与Cr3+反应生成Ag和Cr2O72-,生成的Ag再与S2O82-反应生成Ag+和SO42-。
(4)负极发生氧化反应,是Cr3+放电;正极发生还原反应,是S2O82-放电。
(3)根据催化剂的概念,Ag+的催化过程是:Ag+先与Cr3+反应生成Ag和Cr2O72-,生成的Ag再与S2O82-反应生成Ag+和SO42-。
(4)负极发生氧化反应,是Cr3+放电;正极发生还原反应,是S2O82-放电。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 溶液
溶液 溶液
溶液 溶液
溶液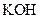 溶液
溶液