题目内容
15.石油化工是江苏省的支柱产业之一.聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:CH2=CH2+Cl2→CH2Cl-CH2C1…①
CH2Cl-CH2C1→CH2=CHCl+HCl…②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率$\frac{实际产量}{理论产量}$=×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯5.8t,同时得到副产物氯化氢3.4t.(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:2CH2=CH2+4HCl+02→2CH2CI-CH2C1+2H20…-③由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺.由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%.试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢).
分析 (1)根据方程式①②可计算出氯乙烯的理论产量,再根据两步反应的产率进行计算氯乙烯的产量,根据反应②可计算出氯化氢的产量;
(2)根据新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余即反应②中产生的氯化氢等于反应③中消耗的氯化氢,结合三个反应的产率进行列等式计算.
解答 解:(1)根据CH2=CH2~CH2Cl-CH2C1~CH2=CHCl~HCl的关系可知,氯乙烯的理论产量为2.8t×$\frac{62.5}{28}$t=6.25t,所以实际产量为6.25t×98%×95%=5.8t,同时得到副产物HCl的实际产量为2.8t××98%×95%×$\frac{36.5}{28}$t=3.4t,
故答案为:5.8;3.4;
(2)设投入反应①、③的乙烯物质的量分别为x、y,则:由反应①生成的二氯乙烷为x•a%,由反应③生成的二氯乙烷为y•c%,
所以由反应①、③共制得二氯乙烷的物质的量为(x•a%+y•c%),通过反应②可获得HCl的物质的量为(x•a%+y•c%)•b%,据题意,反应③消耗的HCl为2•y•c%,
则有2•y•c%=(x•a%+y•c%)•b%,解得:$\frac{x}{y}$=$\frac{200c-bc}{ab}$,所以反应①、③中乙烯的投料比应为$\frac{200c-bc}{ab}$,
答:反应①、③中乙烯的投料比应为$\frac{200c-bc}{ab}$.
点评 本题主要考查根据有机反应的计算,难度中等,根据化学方程式计算是化学学科中最为常见的题型之一,解题时最主要的是根据题意找出等量关系.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
6.在实验室配制0.10mol•L-1的KCl溶液,下列操作会导致所配溶液浓度偏高的是( )
| A. | 转移溶液时使用的烧杯未洗涤 | B. | 定容时俯视读取刻度线 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 转移时有少量溶液流出瓶外 |
3.为探究离子反应的实质,某同学设计了如下实验,有关的实验现象及反应方程式列表如下:
(1)填充表:
(2)实验II反应后的溶液中还有离子种类有6,能证明Cu2+没有参与反应的实验现象是滤液为蓝色.
(1)填充表:
| 编号 | I | II | III |
| 实验 | 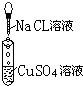 | 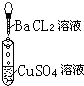 |  |
| 现象 | 有白色沉淀生成,滤液为蓝色 | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | |
| 化学方程式 | 2AgNO3+CuCl2═2AgCl↓+Cu(NO3)2 | ||
| 离子方程式 | Ba2++SO42-═BaSO4↓ |
20.有Na2CO3,Ba(OH)2,H2SO4三种体积和物质的量浓度都相等的溶液,几位同学按不同的顺序将它们混合(产生沉淀立即过滤掉),对于所得溶液,下列结论正确的是( )
| A. | 溶液一定显碱性 | B. | 溶液不可能显碱性 | ||
| C. | 溶液可能显碱性 | D. | 溶液不可能显酸性 |
7.把两种固体混合加入水中,可产生能使澄清的石灰水变浑浊的气体,这两种固体可能是( )
| A. | NaHCO3和Na2O2 | B. | 铝粉和NaOH | C. | Na2SO3和SO3 | D. | Na2CO3和P2O5 |
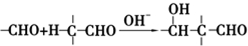
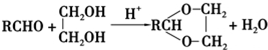
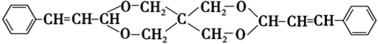
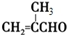 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$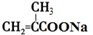 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.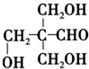 .
.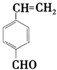 和
和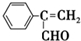 .
.