题目内容
【题目】肼( ![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N﹣N为154、H﹣O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1中数据计算断裂1molN﹣H键所需的能量(kJ)是:
(4)写出NH3与NaClO反应得到肼的化学方程式: .
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol
(3)403
(4)2NH3+NaClO=N2H4+NaCl+H2O
【解析】解:(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(2)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2﹣①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;所以答案是:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;(3)设断裂1molN﹣H键所需的能量为x,由反应及焓变等于反应物中键能之和﹣生成物中键能之和可知, 4x+154+498﹣942﹣2×2×464=﹣534,解得x=403(kJ),所以答案是:403;(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,所以答案是:2NH3+NaClO=N2H4+NaCl+H2O.
CaCl2+2NH3↑+2H2O;(2)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2﹣①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;所以答案是:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;(3)设断裂1molN﹣H键所需的能量为x,由反应及焓变等于反应物中键能之和﹣生成物中键能之和可知, 4x+154+498﹣942﹣2×2×464=﹣534,解得x=403(kJ),所以答案是:403;(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,所以答案是:2NH3+NaClO=N2H4+NaCl+H2O.

 名校课堂系列答案
名校课堂系列答案【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 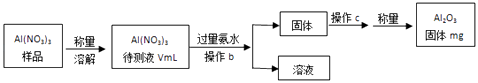
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 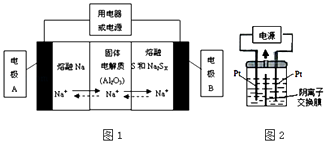
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
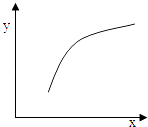
A.A
B.B
C.C
D.D


