��Ŀ����
����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1��Al��NO3��3���Ʊ������ز�����ԭ��֮һ������Al��NO3��3�������ջ����е�ˮ�֣������Ҫ������ж������������岽����ͼ��ʾ�� 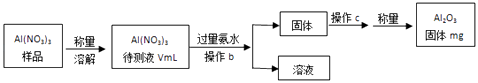
�ټ��������ˮ������Ӧ�����ӷ���ʽΪ�� ��
�ڲ���bΪ��
��Al��NO3��3����Һ�У�c��Al3+��=mol/L���ú�m��V�Ĵ���ʽ��ʾ����
��2�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ�� 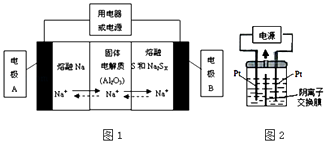
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050�� |
�е�/�� | 892 | 444.6 | 2980 |
�ٸ��ݱ����ݣ������жϸõ�ع���������Ӧ������������ĸ����Χ�ڣ�
A.100������ B.100��300��C.300��350��D.350��2050��
�ڷŵ�ʱ���缫AΪ�����缫B������Ӧ���������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX�T2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ�� ��
��3��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ�����Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ� ��
���𰸡�
��1��Al3++3NH3?H2O�TAl��OH��3��+3NH4+�����ˣ�![]()
��2��C��������ԭ��Sx2����2e���TxS
��3��2H2O+2e��=H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ
���������⣺��1�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �Լ�aΪ��ˮ����Ӧ�ķ���ʽΪAl3++3NH3H2O�TAl��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O�TAl��OH��3��+3NH4+�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �����˵õ�Al��OH��3���壬���Բ���bΪ���ˣ����Դ��ǣ����ˣ���n��Al2O3��= ![]() =
= ![]() mol����n��Al��NO3��3��=2n��Al2O3��=
mol����n��Al��NO3��3��=2n��Al2O3��= ![]() mol�� c��Al��NO3��3��=
mol�� c��Al��NO3��3��= ![]() =
= ![]() mol/L�����Դ��ǣ�
mol/L�����Դ��ǣ� ![]() ����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��
����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��

����Ŀ��ʵ�������ܶ�Ϊ1.25gmL��1����������Ϊ36.5%��Ũ��������240mL 0.1molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ ��
��2������ 240mL 0.1molL��1 ������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
��3������ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�� �� ��
A.��30mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B.����Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ���Ͼ���
C.������ȴ�������ز�����ע������ƿ��
D.������ƿ�ǽ�����ҡ��
E.���ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12cm��
��4����ʵ�������������������������Һ�����ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ�����ƫ�͡����䡱����
������ϡ��������ձ�δϴ�ӣ� ��
������ƿ��ԭ����������ˮ�� ��
�۶���ʱ�۲�Һ�温�ӣ� ��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶� ��
��������ƿ��ת����Һʱ�й�Һ��������Һ���� ��
�۶���ҡ�����Һ���½� ��
����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����H��0�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������ǣ� ��
ѡ�� | x | y |
A | MgSO4����������������� | CO��ת���� |
B | CO�����ʵ��� | CO2��CO�����ʵ���֮�� |
C | SO2��Ũ�� | ƽ�ⳣ��K |
D | �¶� | �����ڻ��������ܶ� |

A.A
B.B
C.C
D.D