题目内容
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
【答案】
(1)2mol/L,2mol/L
(2)0.25L
(3)1mol/L,22.4L
【解析】解:(1)将117g NaCl溶于水配制成1L溶液,该溶液中NaCl的物质的量浓度为C= ![]() =
= ![]() =
= ![]() =2mol/L;氯化钠为强电解质完全电离所以溶液中存在n(Cl﹣)=n(NaCl),C(Cl﹣)=C(NaCl)=2mol/L;
=2mol/L;氯化钠为强电解质完全电离所以溶液中存在n(Cl﹣)=n(NaCl),C(Cl﹣)=C(NaCl)=2mol/L;
所以答案是:2mol/L;2mol/L;
(2)设配制1molL﹣1的NaCl溶液500mL,需要2mol/L氯化钠溶液体积为V,依据溶液稀释前后所含溶质的物质的量不变,1molL﹣1×0.5L=2mol/L×V,
解得V=0.25L;
所以答案是:0.25L;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl﹣),溶液中c(Na+)=2mol/L,c(Cl﹣)=3mol/L,则c(H+)=3mol/L﹣2mol/L=1mol/L,而c(HCl)=c(H+)=1mol/L,故n(HCl)=1L×1mol/L=1mol,故通入HCl的体积=1mol×22.4L/mol=22.4L.
所以答案是:22.4L.

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
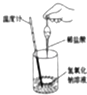
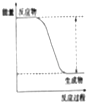
出彩同步大试卷系列答案【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A. | B. | C. | D. | |
反应 |
|
|
|
|
实验现象 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.A
B.B
C.C
D.D
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |
A.A
B.B
C.C
D.D