题目内容
【题目】下列说法正确的是( )
A. 键角越大,该分子越稳定
B. 共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C. CH4、CCl4中键长相等,键角不同
D. C===C键的键能是C—C键的2倍
【答案】B
【解析】A、分子的稳定性与共价键的键长、键能有关,键角决定分子空间构型,故A错误;B、键能越大,共价键越牢固,越不易被破坏,故分子越稳定,故B正确;C、CH4、CCl4均为正四面体,键角相同,但H原子比Cl原子小,甲烷中键长比四氯化碳中的键长短,故C错误;D、乙烯中C=C的键能小于乙烷中C-C的键能的2倍,故D错误,故选B。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】海水中的成盐元素除了氯之外,还有溴和碘。
(1)工业上可用Cl2和NH4Cl溶液反应制取NCl3(NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理)。当用干燥洁净的玻璃棒蘸取NCl3滴到干燥的红色石蕊试纸上,试纸不褪色;若取NCl3滴入50-60oC热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。写出对应该现象的化学方程式:____________________________________________________。
(2)①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:______KIO3+ ______KI + H2SO4 = ______K2SO4+_____I2+ ______
②上述反应生成的I2可用四氯化碳检验,现象为________________________________________。
(3)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量物的/mol | 0.5 | 1.3 | x |
则x= ______;原溶液中NaI的物质的量为______mol。
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436 | 243 | 431 |
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
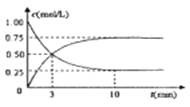
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转换率α(H2)=___________。
②若反应CO2+3H2![]() CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________(填字母)。
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:
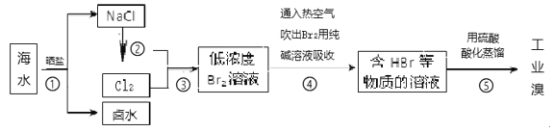
①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________。


