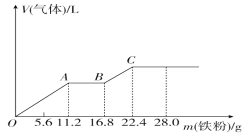
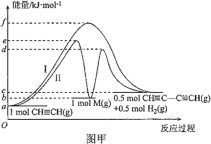
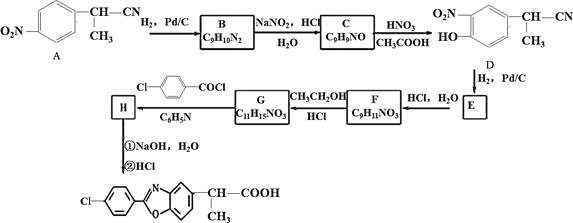
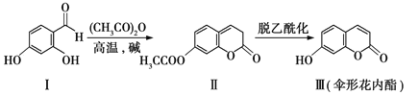
��Ŀ����
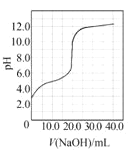
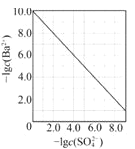
����Ŀ��(1)20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��NO2��CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ��˵�������Ӧ��_________��������������������������Ӧ��NO2��CO��������_________������С������ ��������������������CO2��NO����������
(2)��ij���Ϊ2L���ܱ������г���0.5mol NO2��1mol CO����һ�������·�����Ӧ��NO2+COCO2+NO��2minʱ�����������NO�����ʵ���Ϊ0.2mol����
�ٸö�ʱ���ڣ���CO2��ʾ��ƽ����Ӧ����Ϊ_________��
�ڼ���˷�Ӧ��5minʱ�ﵽƽ�⣬���ʱ����������������ʵ���Ϊ_________��
��������ʵ�ܹ�˵��������Ӧ�ڸ��������Ѿ��ﵽ��ѧƽ��״̬����_________��
A��������������������ֲ���
B��NO2�����ʵ���Ũ�Ȳ��ٸı�
C��NO2������������CO2�������������
D�������������ܵ����ʵ������ֲ���
���𰸡����� ���� 0.05molL��1min��1 1.5mol BC
��������
��1����ͼ��֪����Ӧ��NO2��CO������������������CO2��NO�����������÷�ӦΪ���ȷ�Ӧ��
��2������������г�����ʽ��

���ö�ʱ���ڣ���CO2��ʾƽ����Ӧ����Ϊ��![]() ��
��
����Ӧ��һ��ǰ���������ķ�Ӧ�����Է�Ӧ��5minʱ�ﵽƽ�⣬���ʱ����������������ʵ���=��Ӧǰ������������ʵ���=1.5mol��
����ѧƽ����ж���Ҫ�����ַ�����һ��v��=v�������DZ������䡣
A�������ڵ����巴Ӧǰ����ѭ�����غ㣬����������������Ǹ���ֵ�������ж��Ƿ�ﵽƽ��״̬��A����
B��NO2�����ʵ���Ũ���Ǹ����������ŷ�Ӧ�Ľ��в��ϱ仯���������ٸı�ʱ���÷�Ӧ�ﵽƽ��״̬��B��ȷ��
C��NO2������������Ӧ����CO2���������淴Ӧ������������ȷ��ϻ�ѧ������֮�ȣ���v��=v������Ӧ�ﵽƽ�⣬C��ȷ��
D����Ӧ��һ��ǰ���������ķ�Ӧ����ǰ�����ʵ�������ķ�Ӧ���������ʵ����Ǹ���ֵ�������ж��Ƿ�ﵽƽ��״̬��D����
��ѡBC��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش���������
��1��ZԪ�������ڱ��е�λ��Ϊ__________��
��2��Ԫ�����ڱ�����ZԪ��ͬ����ԭ�Ӱ뾶������(дԪ������)__________��������������Ӧ��ˮ���ﺬ�еĻ�ѧ������____________��
��3��������ʵ��˵��YԪ�صķǽ����Ա���Ԫ�صķǽ�����ǿ����___��
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
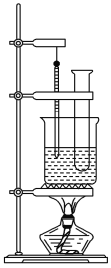
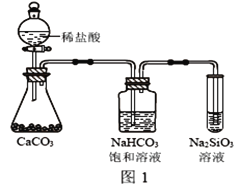
��4��������ͼʵ�飬����֤��̼�ķǽ����Ա�Xǿ������С�մ���Һ������__________�����������ӷ���ʽ�ǣ�__________________
��5����ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵����������________��
a���(D)ԭ�Ӻ�����1������
b��1H��D����ͬλ��
c��H2O��D2O����ͬ��������
d��1H218O��D216O����Է���������ͬ