题目内容
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
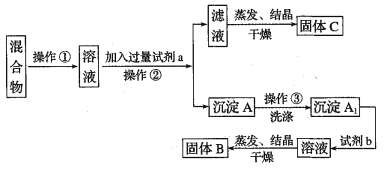
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为_____________________________。
(3)该方案有不足之处,请你把它找出来并改进:_______________________________。
(4)操作③为什么要洗涤沉淀A:_____________________________________________。
【答案】过滤 K2CO3 BaCO3 + 2HCl==BaCl2 + CO2 ↑+ H2O 操作②的滤液中K2CO3未除尽,应加入过量的盐酸,再蒸发结晶 洗去沉淀中有残留的KCl 、K2CO3 可溶性杂质
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,应加入过量盐酸可得KCl,沉淀A为BaCO3,洗涤后,加盐酸,蒸发得到固体B为BaCl2。
(1).将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,则试剂a为K2CO3,试剂b为HCl,固体B为BaCl2,故答案为:过滤;K2CO3;
(2).试剂b为HCl,加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应为BaCO3+ 2HCl=BaCl2+ CO2↑+ H2O,故答案为:BaCO3+ 2HCl=BaCl2+ CO2↑+ H2O;
(3).由上述分析可知,该实验不能达到目的,因操作②的滤液中可能混有碳酸钾,应加过量盐酸后蒸发结晶,故答案为:操作②的滤液中K2CO3未除尽,应加入过量的盐酸,再蒸发结晶;
(4).过滤后的固体表面附着有KCl 、K2CO3可溶性杂质,故答案为:洗去沉淀中有残留的KCl 、K2CO3可溶性杂质。