题目内容
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究. 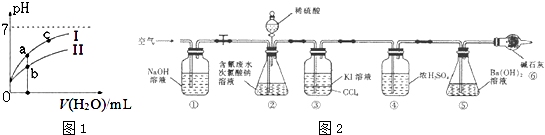
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 |
(1)NaCN溶液呈碱性的原因是(用离子方程式表示)
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN﹣+CO2+H2O=HCN+CO32﹣
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表HCOOH或HCN)
相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为 .
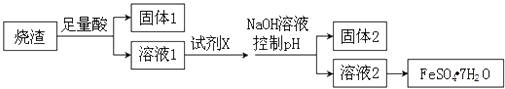
(4)探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN﹣的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4 , 关闭活塞.
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣
2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
处理含CN﹣废水时,如用NaOH溶液调节pH至9时,此时c(CN﹣)c(HCN)(填“>”、“<”或“=”)
(5)①和⑥的作用是 .
(6)反应结束后,缓缓通人空气的目的是 .
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置反应前后的质量(从装置①到⑥中选择,填装置序号).
【答案】
(1)CN﹣+H2O?HCN+OH﹣
(2)CD
(3)KHCO3
(4)<
(5)吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰
(6)使生成的气体全部进入装置⑤
(7)⑤
【解析】解:探究一:探究氰化物的性质(1.)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN﹣+H2OHCN+OH﹣ , 所以答案是:CN﹣+H2OHCN+OH﹣;
(2.)A、醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO﹣)>c(ClO﹣)>c(OH﹣)>c(H+),故A错误;B、碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO﹣+CO2+H2O═HClO+HCO3﹣ , 故B错误;
C、在 ![]() 的分子、分母同时乘以氢离子浓度可得:
的分子、分母同时乘以氢离子浓度可得: ![]() ,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D正确.故选CD.所以答案是:CD;
,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D正确.故选CD.所以答案是:CD;
(3.)H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,KCN+H2O2+H2O=A+NH3↑,由原子守恒可知A的化学式为KHCO3 , 所以答案是:KHCO3;
(4.)处理含CN﹣废水时,用NaOH溶液调节至pH=9时(常温),CN﹣+H2OHCN+OH﹣ , Ka(HCN)=5.0×10﹣10 , Kh= ![]() ×
× ![]() =
= ![]() =
= ![]() =2×10﹣5 , c(OH﹣)=10﹣5 , 则
=2×10﹣5 , c(OH﹣)=10﹣5 , 则 ![]() =2×10﹣5 , 则c(CN﹣)<c(HCN);所以答案是:<;
=2×10﹣5 , 则c(CN﹣)<c(HCN);所以答案是:<;
探究二:测定含氰水样中处理百分率
(5.)实验的原理是利用CN﹣+ClO﹣═CNO+Cl﹣;2CNO﹣+2H++3ClO﹣═N2↑+2CO2↑+3Cl﹣+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰,
所以答案是:吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰;
(6.)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
所以答案是:使生成的气体全部进入装置⑤;
(7.)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量,所以答案是:⑤.