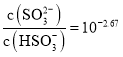��Ŀ����
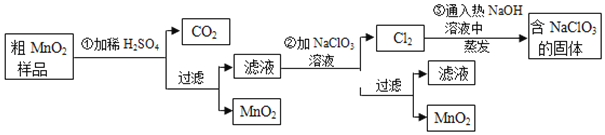
����Ŀ��̼�ᱵ��һ����Ҫ�����β�Ʒ���㷺Ӧ���ڹ�ҵ�մɡ���ѧ��������������ҵ��
![]() �����Ʊ�����ҵ��һ�����ؾ�ʯ
�����Ʊ�����ҵ��һ�����ؾ�ʯ![]() Ϊԭ�ϣ����ø������ջ�ԭ����ʵ����һ�����ؾ�ʯ
Ϊԭ�ϣ����ø������ջ�ԭ����ʵ����һ�����ؾ�ʯ![]() Ϊԭ�ϣ����ó���ת������
Ϊԭ�ϣ����ó���ת������
�������ջ�ԭ����
![]()
![]() ���ջ�ԭ�Ļ�ѧ����ʽΪ��_____________��
���ջ�ԭ�Ļ�ѧ����ʽΪ��_____________��
![]() Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ��__________
Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ��__________![]() ��дһ��
��дһ��![]() ��
��
![]() ������BaS��ˮ��Һ�ʼ��ԣ�ԭ����
������BaS��ˮ��Һ�ʼ��ԣ�ԭ����![]() �����ӷ���ʽ��ʾ
�����ӷ���ʽ��ʾ![]() __________��
__________��
����ת��������![]() �����м��뱥��
�����м��뱥��![]() ��Һ����ֽ��裬��ȥ�ϲ���Һ����˴�����Σ�ֱ��
��Һ����ֽ��裬��ȥ�ϲ���Һ����˴�����Σ�ֱ��![]() ȫ��ת��Ϊ
ȫ��ת��Ϊ![]() ��
��![]() ƽ�ⳣ��
ƽ�ⳣ��![]()
![]() ����
����![]() ��ÿ����
��ÿ����![]() ����
����![]() ��Һ�������ٶ�
��Һ�������ٶ�![]() ��ȫ��ת����������Ҫ����_____________�Ρ�
��ȫ��ת����������Ҫ����_____________�Ρ�
![]() ������ɫ��ѧ���Ƕȷ������ñ���
������ɫ��ѧ���Ƕȷ������ñ���![]() ��Һ����ת�������ŵ��ǣ�__________��
��Һ����ת�������ŵ��ǣ�__________��
![]() �����ᴿ
�����ᴿ
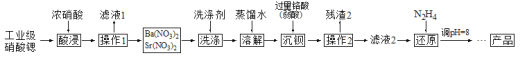
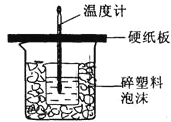
ijʵ���ҷ����ᴿ��������̼������ʵ�̼�ᱵ��Ʒ�IJ������£�
![]() �����պ�Ĺ�����������
�����պ�Ĺ�����������![]() ����ˮ�У��Ƴ������������ȱ�����Һ��Ϊ����
����ˮ�У��Ƴ������������ȱ�����Һ��Ϊ����![]() ����ʧ����ȥ������Ӧ���еIJ�����_____��
����ʧ����ȥ������Ӧ���еIJ�����_____��
![]() ���Ƶõ�
���Ƶõ�![]() ��Һ�еμ�_______
��Һ�еμ�_______![]() ��һ���Լ�����
��һ���Լ�����![]() ����ͨ�������̼�����۲쵽_______ʱ������ֹͣͨ������̼��
����ͨ�������̼�����۲쵽_______ʱ������ֹͣͨ������̼��
![]() �������
�������
![]() �������ij������ˮ��
�������ij������ˮ��![]() ��Ũ�ȡ�ȡ��ˮ
��Ũ�ȡ�ȡ��ˮ![]() �������ʵ�����ȼ���������
�������ʵ�����ȼ���������![]() ��Һ����
��Һ����![]() ������������ϴ�ӡ����˺���������ϡ�����ܽ⣬��ʱ
������������ϴ�ӡ����˺���������ϡ�����ܽ⣬��ʱ![]() ȫ��ת��Ϊ
ȫ��ת��Ϊ![]() ���ټ������KI��Һ����ӦҺ���ٵμ�
���ټ������KI��Һ����ӦҺ���ٵμ�![]() ��Һ����Ӧ��ȫʱ������
��Һ����Ӧ��ȫʱ������![]() ��Һ
��Һ![]() ����֪�йص����ӷ���ʽΪ��
����֪�йص����ӷ���ʽΪ��![]() ��
��![]() ��
��
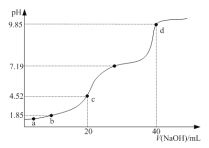
�ù�����ˮ��![]() �����ʵ���Ũ��__________
�����ʵ���Ũ��__________![]()
���𰸡�![]()
![]()
![]() �ʵ�����¶�
�ʵ�����¶�![]() ������
������![]()
![]()
![]() ���ܣ����� ���ȹ��� ��̪ ��ɫ�պ���ʧ
���ܣ����� ���ȹ��� ��̪ ��ɫ�պ���ʧ ![]()
��������
![]() ������ͼ��֪���ջ�ԭ��C��
������ͼ��֪���ջ�ԭ��C��![]() ��Ӧ����BaS��CO��
��Ӧ����BaS��CO��
![]() ͨ����������顢���Ȼ����ȴ�ʩ��߹�����ܽ����ʣ�
ͨ����������顢���Ȼ����ȴ�ʩ��߹�����ܽ����ʣ�
(3)�����ӵ�ˮ��ʹBaS��ˮ��Һ�ʼ��ԣ�
![]() ��ÿ����
��ÿ����![]() ����
����![]() ��Һ�ܴ���
��Һ�ܴ���![]() ���ʵ���Ϊx������
���ʵ���Ϊx������![]() ����֪x=
����֪x=![]() =
=![]() ��
��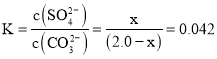 ����ã�
����ã�![]() ���ɴ˼��㴦��������
���ɴ˼��㴦��������
![]() �ɽ����Դ���ĺͻ�������������
�ɽ����Դ���ĺͻ�������������
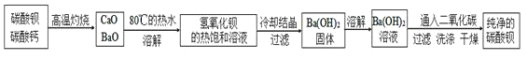
(6)�����̿�֪����������̼������ʵ�̼�ᱵ��Ʒ���ȷֽ�����CaO��BaO��������ˮ�õ����������ı�����Һ���������Ƶ��ܽ��С�����������˷��������Ϊ�������ƣ���Һ��������������ȴ�ᾧ���ᴿ����������ˮ��ͨ�������̼����̼�ᱵ���Դ������
![]() ��Һ�з����ķ�ӦΪ��2Ba2++Cr2O72-=2BaCrO4+2H+��Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O��I2+2S2O32-=2I-+S4O62-�����ݷ���ʽ�г������ʵĹ�ϵΪBa2+��BaCrO4��
��Һ�з����ķ�ӦΪ��2Ba2++Cr2O72-=2BaCrO4+2H+��Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O��I2+2S2O32-=2I-+S4O62-�����ݷ���ʽ�г������ʵĹ�ϵΪBa2+��BaCrO4��![]() Cr2O72-��
Cr2O72-��![]() I2��3S2O32-���ݴ˷������⡣
I2��3S2O32-���ݴ˷������⡣
![]() ������ͼ��֪���ջ�ԭ��C��
������ͼ��֪���ջ�ԭ��C��![]() ��Ӧ����BaS��CO����Ӧ�ķ���ʽΪ��
��Ӧ����BaS��CO����Ӧ�ķ���ʽΪ��![]()
![]()
![]() ��
��
![]() Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ���ʵ�����¶ȡ������������ȣ�
Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ���ʵ�����¶ȡ������������ȣ�
![]() ��ˮ��Һ�ʼ��ԣ�����Ϊ������ˮ�⣬ˮ������ӷ���ʽΪ��
��ˮ��Һ�ʼ��ԣ�����Ϊ������ˮ�⣬ˮ������ӷ���ʽΪ��![]() ��
��
![]() ��ÿ����
��ÿ����![]() ����
����![]() ��Һ�ܴ���
��Һ�ܴ���![]() ���ʵ���Ϊx������
���ʵ���Ϊx������![]() ����֪x=
����֪x=![]() =
=![]() ��
��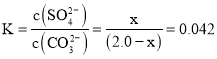 ����ã�
����ã�![]() ����������
����������![]() �����ٴ���3�Σ�
�����ٴ���3�Σ�
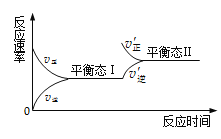
![]() ����ת�����൱�ڸ������ջ�ԭ�����ŵ��ǣ���Ӧ�ڳ����½��У����Խ�Լ��Դ����Ӧ������CO����Ⱦ�����壬������
����ת�����൱�ڸ������ջ�ԭ�����ŵ��ǣ���Ӧ�ڳ����½��У����Խ�Լ��Դ����Ӧ������CO����Ⱦ�����壬������
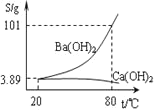
![]() ������ͼ���ܽ�����߿�֪
������ͼ���ܽ�����߿�֪![]() ���ܽ�����¶�����Ѹ���������ȥ
���ܽ�����¶�����Ѹ���������ȥ![]() �л��е�
�л��е�![]() ʱӦ����Ũ�������ȹ��˳�ȥ
ʱӦ����Ũ�������ȹ��˳�ȥ![]() ������ȴ�ᾧ���
������ȴ�ᾧ���![]() ��
��
![]() ��Һ�з����ķ�ӦΪ��2Ba2++Cr2O72-=2BaCrO4+2H+��Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O��I2+2S2O32-=2I-+S4O62-�����ݷ���ʽ�г������ʵĹ�ϵΪBa2+��BaCrO4��
��Һ�з����ķ�ӦΪ��2Ba2++Cr2O72-=2BaCrO4+2H+��Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O��I2+2S2O32-=2I-+S4O62-�����ݷ���ʽ�г������ʵĹ�ϵΪBa2+��BaCrO4��![]() Cr2O72-��
Cr2O72-��![]() I2��3S2O32-����n(Ba2+)=3n(S2O32-)=
I2��3S2O32-����n(Ba2+)=3n(S2O32-)=![]() ��0.100molL-1��36.00��10-3 L=1.2��10-3mol������c(Ba2+)�T
��0.100molL-1��36.00��10-3 L=1.2��10-3mol������c(Ba2+)�T![]() =0.024molL-1��
=0.024molL-1��

����Ŀ���Ȼ�������SOCl2��������ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ��Ҳ�����л��ϳɹ�ҵ�����Ȼ�������֪��SOCl2������������±���ʾ��
��ɫ��״̬ | �۵� | �е� | ��ʴ�� | ˮ�� |
��ɫ����Һ�� | -105�� | 78�� | ǿ | ����ˮ�� |
��������ͼװ���Ʊ�SOCl2��
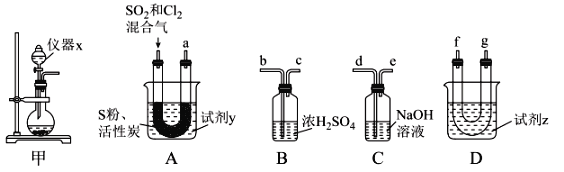
��ش��������⣺
���Ʊ�SO2��Cl2��
��1����ʵ��ѡ��װ�ü��Ʊ�SO2��Cl2��װ�ü�������x������Ϊ___������KMnO4��Ũ���ᷴӦ�Ʊ�Cl2����Ӧ�����ӷ���ʽΪ___��
���Ʊ�SOCl2��
�Ի���̿��Ϊ������SO2��C12���Ժ�S����180~200��ʱ��Ӧ�ϳ�SOCl2��ѡ��װ��A��B��C��D�����Ʊ����г֡�����װ����ȥ����
��2�������������ҵķ���װ��A��B��C��D������˳��Ϊ____���������ӿڵ���ĸ��ţ���
��3���Լ�yΪ___����ѡ����ĸ����ͬ�����Լ�zΪ___��
A����ˮ B���Ҵ� C��ʯ���� D����ˮ
��4��װ��A��U�ι��ڷ�����Ӧ�Ļ�ѧ����ʽΪ___��
��5��װ��C������Ϊ___����װ��A��ͨ���SO2��Cl2�����ʵ���֮��Ϊ1��3����װ��C�����ɵ���Ϊ___���ѧʽ����