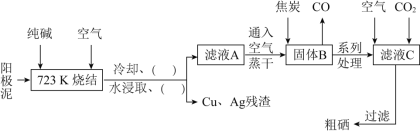题目内容
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
请回答下列问题:
Ⅰ.制备SO2和Cl2。
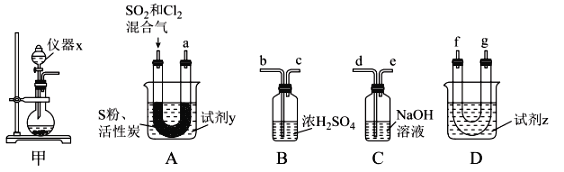
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为____(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式)。
【答案】分液漏斗 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O afg(gf)bcde C D SO2+2Cl2+S![]() 2SOCl2 尾气处理(或吸收未反应的SO2和Cl2) NaC1、NaClO和Na2SO4
2SOCl2 尾气处理(或吸收未反应的SO2和Cl2) NaC1、NaClO和Na2SO4
【解析】
Ⅰ.(1)根据仪器构造可得;高锰酸钾和浓盐酸反应制备Cl2,同时生成氯化锰、氯化钾和水;
Ⅱ.(2)A为制备装置,D为收集装置,B为干燥装置,连接在D后防止水蒸气进入,C为尾气处理装置;
(3)反应条件为在180~200℃,选择石蜡油维持;装置D为冷凝收集产品的装置,试剂z为冷凝,据此分析;
(4)装置A中U形管内为二氧化硫和氯气在180~200℃催化剂催化下生成SOCl2;
(5)SO2和Cl2为有毒气体,考虑尾气处理;装置A处通入的SO2和Cl2的物质的量之比为1:3,Cl2过量装置C中发生的反应为SO2+Cl2+4NaOH═2NaCl+Na2SO4+2H2O、Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅰ.(1)装置甲中仪器x的名称为分液漏斗;若选用装置甲以高锰酸钾和浓盐酸反应制备Cl2,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:分液漏斗 ; 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ;
Ⅱ.(2)按气流从左到右的方向,A为制备装置,D为收集装置,B为干燥装置,连接在D后防止水蒸气进入,C为尾气处理装置,连接顺序为afg(gf)bcde,
故答案为:afg(gf)bcde;
(3)试剂y为石蜡油,能保持油浴温度为180~200℃;试剂z为冰水,冷凝收集生成的氯化亚砜,
故答案为C; D;
(4)装置A中U形管内发生反应的化学方程式为SO2+2Cl2+S![]() 2SOCl2。
2SOCl2。
(5)装置C的作用为吸收未反应的SO2和Cl2;若装置A处通入的SO2和Cl2的物质的量之比为1:3,Cl2过量,则装置C中发生的反应为SO2+Cl2+4NaOH=2NaCl+Na2SO4+2H2O、Cl2+2NaOH=NaCl+NaClO+H2O,生成的盐为NaCl、Na2SO4和NaClO;
故答案为:尾气处理(或吸收未反应的SO2和Cl2) ; NaC1、NaClO和Na2SO4

 阅读快车系列答案
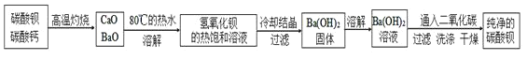
阅读快车系列答案【题目】磷酸亚铁![]() 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产![]() 的原料,实验室利用
的原料,实验室利用![]() 、
、![]() 及
及![]() 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
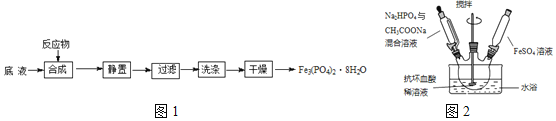
合成时的主要反应为:![]()
![]() 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
![]() 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸![]() 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入![]() 与
与![]() 混合溶液至
混合溶液至![]() 时,再滴入
时,再滴入![]() 溶液,最终维持
溶液,最终维持![]() 装置如图2所示
装置如图2所示![]() 。
。
![]() 实验不是将三种溶液直接混合的原因是______。
实验不是将三种溶液直接混合的原因是______。
![]() 用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
![]() 生成的
生成的![]() 沉淀需充分洗涤,检验洗涤是否完全的方法是______
沉淀需充分洗涤,检验洗涤是否完全的方法是______
![]() 检验产品中是否混有
检验产品中是否混有![]() 或
或![]() 杂质的方法是______。
杂质的方法是______。
![]() 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠![]() 含
含![]() 、重金属盐及有色杂质等
、重金属盐及有色杂质等![]() 提纯得到
提纯得到![]() 晶体。已知:
晶体。已知:![]() 溶液pH
溶液pH![]() ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
![]() 实验中必须使用的试剂有:
实验中必须使用的试剂有:![]() 溶液、活性炭、
溶液、活性炭、![]() 溶液、乙醇
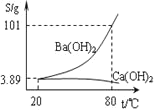
溶液、乙醇![]() 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度![]() 水
水![]()
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|
|
|
|
| |||||||
|
| ||||||||||
|
|
|
|
|
| ||||||
|
|
将工业品溶于适量热水,______。