题目内容
下列有关溶液的叙述错误的是
| A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1 |
| B.常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol·L-1,则该溶液可能为NaOH溶液 |
| C.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比小于2∶1 |
| D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
D
A:常温下醋酸铵溶液呈中性,是由于CH3COO—与NH4+水解程度相当所至;既然呈中性,溶液中c(H+)和c(OH-)必然相等且均为为1.0×10-7。
B:常温下,水电离出来的c(OH-)=1.0×10-12 mol·L-1远小于1.0×10-7 mol·L-1,电离受抑制,完全可能是由于NaOH电离出的OH—引起。
C:假设醋酸为强酸,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比应等于2∶1,可是由于醋酸是弱酸,1 mol·L-1醋酸溶液稀释为0.5 mol·L-1醋酸溶液的过程中,促进及电离,致使酸性相对增强,导致c(H+)之比小于2∶1。
D:导电性与溶液中自由移动离子的浓度相关,本选项描述错误。
B:常温下,水电离出来的c(OH-)=1.0×10-12 mol·L-1远小于1.0×10-7 mol·L-1,电离受抑制,完全可能是由于NaOH电离出的OH—引起。
C:假设醋酸为强酸,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比应等于2∶1,可是由于醋酸是弱酸,1 mol·L-1醋酸溶液稀释为0.5 mol·L-1醋酸溶液的过程中,促进及电离,致使酸性相对增强,导致c(H+)之比小于2∶1。
D:导电性与溶液中自由移动离子的浓度相关,本选项描述错误。

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
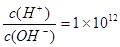 ,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是( )
,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是( )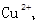 Fe3+、NO3-、SO42-
Fe3+、NO3-、SO42-