题目内容
工业上用某矿渣(主要成分为Cu2O,还含有Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
(固体混合物B经处理后可回收铜)
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐材质的仪器,除玻璃棒、酒精灯、泥三角外,还有_________(填仪器名称)。
(2)滤液A中铁元素的存在形式为_______(填离子符号),生成该离子的离子方程式为_____________________。
检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=_______。
(4) ①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→_____________________ _______→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
(1)过滤 坩埚
(2)Fe2+ 2Fe3+ + Cu = 2Fe2+ + Cu2+ 硫氰化钾溶液和新制氯水(写化学式不给分)
(3)11 (4)①bc ②将浓硫酸用蒸馏水稀释,将样品与足量稀硫酸充分反应
解析试题分析:矿渣中的Al2O3、Fe2O3均与盐酸反应,分别生成AlCl3、FeCl3,Cu2O与盐酸反应生成Cu和Cu2+,溶液中的Fe3+与Cu反应:2Fe3+ + Cu = 2Fe2+ + Cu2+,SiO2不与盐酸反应,通过过滤把Cu、SiO2与溶液分离,所以固体混合物B经处理后可回收铜,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2–,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解精炼可得纯铜。
(1)分离固体与液体的混合物采用过滤的方法,灼烧固体应放在坩埚中。
(2)由以上分析知,滤液A中铁元素的存在形式为Fe2+,生成该离子的离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+,检验Fe2+的试剂为硫氰化钾溶液和新制氯水。
(3)设pH=a,NaAlO2溶液显碱性是由AlO2–水解所致,所以水电离出的氢氧根离子浓度为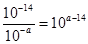 ,NaOH抑制水的电离,水电离出的OH–浓度为10–amol·L–1,
,NaOH抑制水的电离,水电离出的OH–浓度为10–amol·L–1, ,则2a–14 =8,a=11。
,则2a–14 =8,a=11。
(4)①电解过程中,电能除转化为化学能外,还有部分转化为热能,a项错误;电解精炼时粗铜应为阳极,与电源的正极相连,发生氧化反应,b项正确;电解时,粗铜中的铁、铝也放电,而阴极只有Cu2+得电子,所以溶液中的Cu2+浓度略有降低,c正确;根据电极反应Cu2+ + 2e– = Cu可知,阴极析出铜的物质的量是转移电子物质的量的二分之一,错误。②粗铜为Cu、Al和Fe的混合物,浓硫酸稀释后,稀硫酸可与混合物中的Al和Fe反应,而铜不反应,通过反应前后固体的质量差可测定铜的质量分数。
考点:考查实验设计、实验原理分析、离子检验、离子方程式的书写、pH计算等内容,考查信息处理能力 和综合分析能力。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:
(1)碱浸泡过程中,铝被溶解的离子方程式为__________________________
(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。草酸钴是制备氧化钴及钴粉的重要原料。在空气中CoC2O4·2H2O的热分解失重数据见下表,请补充完整表中的热分解方程式。
| 序号 | 温度范围/℃ | 热分解方程式 | 固体失重率 |
| ① | 120~220 | | 19.67% |
| ② | 280~310 | | 56.10% |
(3)过滤Li2CO3时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_____________________________________________________________
(4)最终所得的FeCl3溶液可作净水剂,试结合离子方程式解释其净水原理________________________________________________________
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是: ;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
(1)假设①:该混合金属粉末中除镁外还含有铝元素;
假设②:该混合金属粉末中除镁外还含有锌元素;
假设③: 。
●实验探究:
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设3设计另一实验方案如下:
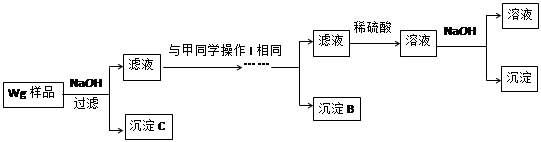
(2)试剂M是________________;沉淀B是 。
(3)丙同学认为乙同学的方案比甲同学的好,理由是 。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。
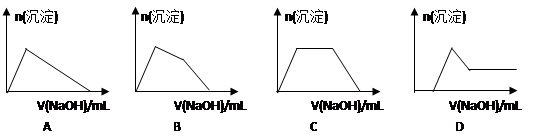
某工厂废液中含有苯酚、乙酸苯酚酌,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L-1 NaOH、0.1 mol?L-1 KSCN、酸性KMnO4溶液、FeCl3溶液、饱和浪水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入KBrO3浓度为0.01667 moL·L-1的KBrO3+KBr标准溶液30.00mL,酸化并放置。待反应完全后,加入过量的KI,再用0.1100 mol?L-1Na2S2O3标准溶液滴成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。
(部分反应离子方程式:BrO3-+5Br-+6H+=3Br2+3H2O、I2+2S2O32-=2I-+S4O62-)


 、
、 、
、 、
、 等]。某主要生产
等]。某主要生产 、
、 的化工厂利用钡泥制取
的化工厂利用钡泥制取 ,其部分工艺流程如下:
,其部分工艺流程如下:
 ,
, 的反应化学方程式为 。
的反应化学方程式为 。