题目内容
某工厂废液中含有苯酚、乙酸苯酚酌,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L-1 NaOH、0.1 mol?L-1 KSCN、酸性KMnO4溶液、FeCl3溶液、饱和浪水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入KBrO3浓度为0.01667 moL·L-1的KBrO3+KBr标准溶液30.00mL,酸化并放置。待反应完全后,加入过量的KI,再用0.1100 mol?L-1Na2S2O3标准溶液滴成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。
(部分反应离子方程式:BrO3-+5Br-+6H+=3Br2+3H2O、I2+2S2O32-=2I-+S4O62-)
(17分)
(1)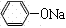 + CO2 + H2O
+ CO2 + H2O 
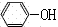 + NaHCO3 (3分)
+ NaHCO3 (3分)
(2)分液 (3分)
(3)(共8分,合理即给分)实验操作 预期现象 现象解释 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。
出现白色浑浊(1分)
苯酚常温下溶解度不大 (1分)
步骤2:取少量C的稀溶液分装b、c两支试管,往b试管滴入过量(1分)饱和溴水(1分),振荡。
产生白色沉淀
苯酚与溴发生取代反应,生成三溴苯酚白色沉淀。(1分)
步骤3:往c试管滴入几滴(1分)FeCl3溶液(1分),振荡。 溶液变为紫色
(1分)C与加入的试剂发生显色反应。
(4)(0.01667×30.00×10-3—0.1100×11.80×10-3× )×
)×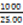 mol
mol
或 ×(0.01667×30.00×10-3×3—0.1100×11.80×10-3×
×(0.01667×30.00×10-3×3—0.1100×11.80×10-3× )×
)×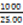 mol
mol
(3分,单位、有效数字错漏各扣1分,合理即给分)
解析试题分析:(1)苯酚与NaOH发生中和反应,得到苯酚钠和水,乙酸苯酚酯与NaOH溶液发生水解反应或取代反应,生成乙酸钠、苯酚钠和水,由此推断A的主要成分是苯酚钠和乙酸钠、水,由于酸性:乙酸>碳酸>苯酚>碳酸氢根离子,则通入二氧化碳气体时发生的反应为苯酚钠与二氧化碳、水发生复分解反应,生成苯酚和碳酸氢钠;(2)由于苯酚的沸点为182℃,根据B变为C的条件推断③为蒸馏,则B为液态有机相,而D为水相,因此推断②为分液;C为苯酚,D为乙酸钠、碳酸氢钠和水;(3)苯酚在常温下溶解度较小,与NaOH溶液混合能发生中和反应,生成苯酚钠和水;与饱和溴水能发生取代反应,生成白色的三溴苯酚沉淀和氢溴酸;遇氯化铁溶液显紫色;根据上述性质可以设计如下实验方案,步骤1:取少量C放入a试管,加入少量蒸馏水,振荡,出现白色浑浊,说明常温下苯酚在水中的溶解度较小;步骤2:取少量C的稀溶液分装b、c两支试管,往b试管中滴入1-2滴或少量饱和溴水,产生白色沉淀,说明苯酚与溴发生取代反应生成三溴苯酚白色沉淀;步骤3:往c试管滴入几滴FeCl3溶液,振荡,溶液变为紫色,说明C与加入试剂发生显色反应;(4)由于n=c?V,则KBrO3的物质的量为0.01667mol/L×30.00×10-3L=0.01667×30.00×10-3 mol;由于BrO3-+5Br-+6H+=3Br2+3H2O中各物质的系数之比等于物质的量之比,则该反应生成的Br2的物质的量为0.01667×30.00×10-3 ×3mol;设25.00mL试样中C或苯酚物质的量为xmol,由于1mol苯酚与3molBr2与发生取代反应,生成三溴苯酚和溴化氢,则xmol苯酚与3xmol Br2与发生取代反应,所以剩余的Br2的物质的量为(0.01667×30.00×10-3 ×3—3x)mol;由于Br2+2KI=2KBr+I2中各物质的系数之比等于物质的量之比,则加入过量KI时生成的I2的物质的量为(0.01667×30.00×10-3 ×3—3x)mol;由于n=c?V,则Na2S2O3的物质的量为0.1100mol/L×11.80×10-3L=0.1100×11.80×10-3 mol;由于I2+2S2O32-=2I-+S4O62-中各物质的系数之比等于物质的量之比,则(0.01667×30.00×10-3 ×3—3x) ×2=0.1100×11.80×10-3,解得:x=0.01667×30.00×10-3—0.1100×11.80×10-3×1/6;由于1000mL容量瓶只能配制1000mL溶液,则25.00mL溶液来自1000mL,因此1000mL溶液中苯酚的物质的量为(0.01667×30.00×10-3—0.1100×11.80×10-3×1/6)mol×1000mL/25.00mL。
考点:考查综合实验与化学计算,涉及苯酚钠溶液与二氧化碳气体反应的化学方程式、混合物分离提纯的常用方法、设计实验方案验证苯酚的重要性质、物质的量在化学或离子方程式计算中的应用、测定苯酚的物质的量等。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |


请回答下列问题:
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol?L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2?H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表: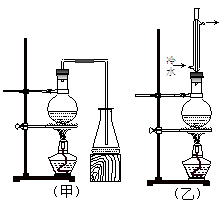
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
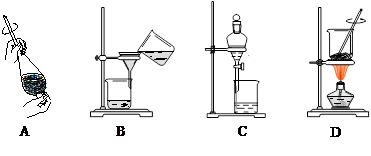
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是 (选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。



 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的

 Na2S2O3(aq)
Na2S2O3(aq)
