题目内容
【题目】常温下,0.1 mol/L 的某二元酸H2A的溶液中可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH的变化如图所示,下列说法中不正确的是

A. H2A的电离方程式为H2A![]() HA-+H+, HA-
HA-+H+, HA-![]() H++A2-
H++A2-
B. Na2A溶液一定呈碱性,NaHA溶液一定呈酸性
C. 常温下,电离常数K(HA-)=10-3
D. W点的溶液中pH=3-lg3
【答案】A
【解析】A、二元酸H2A溶液中不存在其分子,说明第一步完全电离,二元酸H2A的电离方程式为:H2A=H++HA-,HA-H++A2-,故A错误;B. 根据A的分析,Na2A溶液水解显碱性,NaHA溶液不水解,只存在电离显酸性,故B正确;C. 根据图像,pH=3时,c(HA-)=c(A2-),常温下,电离常数K(HA-)=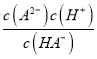 = 10-3,故C正确;D. W点c(HA-)=0.075mol/L,c(A2-)=0.025mol/L,则溶液中c(H+)=
= 10-3,故C正确;D. W点c(HA-)=0.075mol/L,c(A2-)=0.025mol/L,则溶液中c(H+)=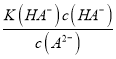 =3× 10-3 mol/L,pH=3-lg3,故D正确;故选A。
=3× 10-3 mol/L,pH=3-lg3,故D正确;故选A。

【题目】A、B、C、D为短周期元素,请根据下表信息回答问题。
元素 | A | B | C | D |
性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(1)B在元素周期表的位置:_________________。
(2)工业上电解法冶炼单质C的化学方程式为_______________。
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质;D的单质与A的另一种氢化物反应生成A的单质。有关反应的化学方程式为:________;______。
(4)D的最高价氧化物为无色液体,该物质与水混合得到一种强酸溶液,该反应的化学方程式为_________________________________________。


