题目内容
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
①写出该反应的离子方程式 ______ .
②用双线桥标出该反应电子转移的方向和数目 ______ .
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,则消耗硝酸为 ______ mol,
被还原的硝酸为 ______ mol
生成NO的体积为 ______ L(标准状况)
【答案】 3Cu+8H+ +2 NO3-═3Cu2+ + 2NO↑+4H2O 用双线桥标出该反应电子转移的方向和数目.
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O 0.8 mol 0.2 mol 4.48L(标准状况)
【解析】①HNO3和Cu(NO3)2 是强电解质,反应的离子方程式3Cu+8H+ +2 NO3-═3Cu2+ + 2NO↑+4H2O ;②在反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,
则双线桥法标出电子得失的方向和数目为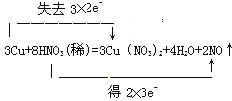
③![]() ,由方程式可知,应消耗0.8molHNO3,被还原的HNO3为0.2mol,生成NO的体积为 4.48L(标准状况)。
,由方程式可知,应消耗0.8molHNO3,被还原的HNO3为0.2mol,生成NO的体积为 4.48L(标准状况)。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目