题目内容
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
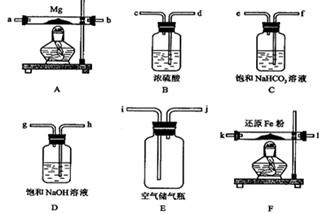
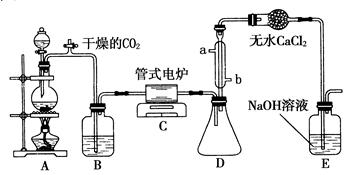
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。现利用图10所示装置进行实验。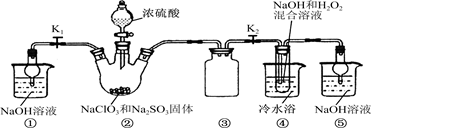
(1)装置③的作用是____________________。
⑵装置②中产生ClO2的化学方程式为____;
装置④中制备NaClO2的化学方程式为____。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;②趁热过滤;③____________;④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
⑷达到滴定终点时的现象为________________。
⑸该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
⑹在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________________。
(1)防止倒吸(或其他正确说法)(2分)
(2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O(2分)
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(2分)
(3)用38 ℃~60 ℃的温水洗涤(2分,仅写 “洗涤”给1分)
(4)溶液由蓝色变为无色且半分钟不变色(2分,“半分钟”不写不扣分)
(5) %(2分),(6)4I-+O2+4H+=2I2+2H2O (2分)
%(2分),(6)4I-+O2+4H+=2I2+2H2O (2分)
解析

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案某研究性学习小组为测定NH3分子中氮、氢原子个数比,设计如下实验流程:
实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。
下图A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
请回答下列问题:
(1)写出仪器的名称:a ,b 。
(2)硬质玻璃管中发生的反应方程式是 ,反应过程中硬质玻璃管的现象是 。
(3)请判断制取氨气可能用到的装置,在下表中你认为可行的装置中填写对应的实验药品(写出化学式)。
| 装置 | 实验药品 |
| A | |
| B | b: a: |
| C | c: 隔板: |
(4)实验时洗气瓶D中的浓硫酸表现 性;该小组实验测得:洗气前装置D的质量为m1g、洗气后装置D的质量为m2g、生成的氮气在标准状况下的体积为V L。根据该小组计算NH3分子中氮、氢的原子个数比的表达式,请预计该结果与理论值相比, 。
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)某兴趣小组采用如图所示装置制取SO2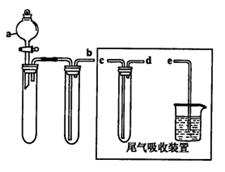
①下列实验方案适用如图所示装置制取所需SO2的试剂是_______(填序号)。
| A.Na2SO3溶液与稀硝酸 |
| B.Na2SO3固体与浓硫酸 |
| C.固体硫和氧气 |
| D.铜与浓硫酸 |
③尾气吸收装置的连接顺序是b接( )接 ( )接e。
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(
 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
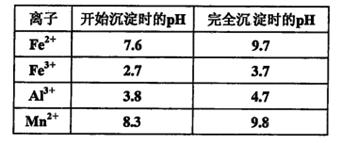
请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理________________________。
②浸出过程中主要反应的化学方程式是___________________________________________。
③氧化过程中加入MnO2粉的目的是______________________________________________;
反应的离子方程式是_________________________________________________________。
④用石灰浆调节pH,pH应调节的范围是___________________________________。
⑤滤渣的主要成分是____________________________________。
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: 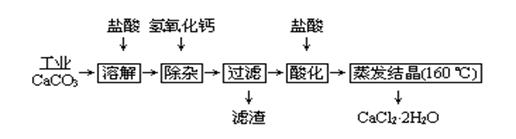
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(1)CaCO3与盐酸反应的离子方程式 。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为 ,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
。
(3)过滤时需用的玻璃仪器有 。滤渣主要成分的化学式 。
(4)酸化时加盐酸的目的为:① ,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃: 。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
 =_____。
=_____。
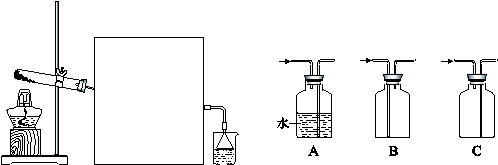
 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C;
2MgO+C; MgO+H2↑; ⑤Mg3N2 +6H2O
MgO+H2↑; ⑤Mg3N2 +6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑