题目内容
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(1)O2进入的电极为___极。
(2)电池工作时:溶液中的OH-向___(填“正极”或“负极”)迁移,通__(填“H2”或“O2”)一极的电势较低。
(3)写出电池工作时的负极反应式:___。
(4)若电池工作时转移0.01mol电子,理论上消耗标准状态下__mLO2。
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极反应式为:__。
【答案】正 负 H2 H2-2e-+2OH-═2H2O 56 CH4+10OH-﹣8e-═![]() +7H2O
+7H2O
【解析】
通常在原电池反应中,O2只能得电子,所以通O2的电极为正极,在碱性电解质溶液中,O2得电子的产物与溶液反应生成OH-,电极反应式为O2+4e-+2H2O==4OH-;通H2的电极为负极,H2失电子的产物与电解质溶液反应生成H2O,电极反应式为H2-2e-+2OH-==2H2O。
(1)由以上分析知,O2进入的电极为正极。答案为:正;
(2)电池工作时:阴离子向负极移动,则溶液中的OH-向负极迁移;在原电池中,负极的电势较低,则通H2一极的电势较低。答案为:负;H2;
(3)电池工作时,通H2的电极为负极,H2失电子的产物与电解质溶液反应生成H2O,电极反应式为H2-2e-+2OH-==2H2O。答案为:H2-2e-+2OH-═2H2O;
(4)在正极O2——4e-,若电池工作时转移0.01mol电子,理论上消耗标准状态下O2的体积为![]() =56mL。答案为:56;
=56mL。答案为:56;
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极为通CH4的电极,CH4失电子的产物与OH-反应生成![]() 和水,电极反应式为:CH4+10OH-﹣8e-═
和水,电极反应式为:CH4+10OH-﹣8e-═![]() +7H2O。答案为:CH4+10OH-﹣8e-═
+7H2O。答案为:CH4+10OH-﹣8e-═![]() +7H2O。
+7H2O。

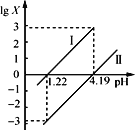
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
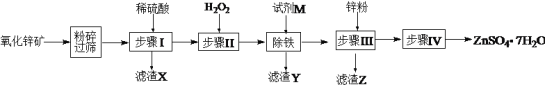
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
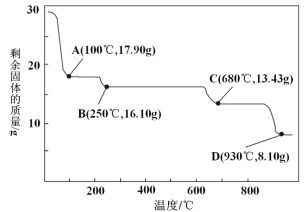
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
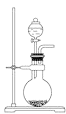
【题目】某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
Ⅰ.制备溴苯
(1)装置中长导管a的作用是__________、导出气体。
(2)本实验所获得的溴苯为褐色,是因为_________.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如图2流程:
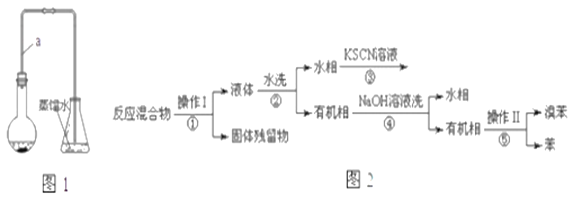
(3)操作Ⅱ为________.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、___;流程③的现象为____,流程④的作用是_____.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr,你认为该同学的判断________(填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
实验步骤 | 预期现象 | 结论 |
1.将锥形瓶中的液体转入分液漏斗,加足量①__,振荡后分液。分别取少量②_层溶液于试管A、B中 | _______ | ______ |
2.向试管A中加入少量③___和四氯化碳,振荡后静置; | 溶液分层,下层显④___色 | 锥形瓶中液体含大量Br |
3.向试管B中加入⑤___. | 有汽泡生成 | 锥形瓶中液体含大量⑥___ |
根据上述结论推断,制备溴苯的反应属于___反应,其反应方程式为______。