题目内容
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A===H++HA-,HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因________________。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是____________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________(填“>”、“<”或“=”)0.11 mol·L-1;理由是_______________________。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
(5)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
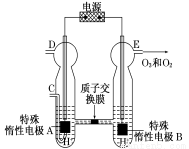
①图中阴极为______________(填“A”或“B”),其电极反应式 为_______________________。
为_______________________。
②若C处通入O2,则A极的电极反应式为______________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为______________(忽略O3的分解)。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 物质的量浓度关系正确的是
物质的量浓度关系正确的是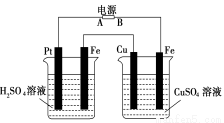
 bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且 达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是 的物质的量浓度为
的物质的量浓度为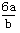 mol·L-1 B.
mol·L-1 B.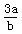 mol·L-1 C.
mol·L-1 C.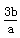 mol·L-1 D.
mol·L-1 D.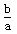 mol·L-1
mol·L-1