题目内容
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是( )
Fe2++Cr3+。下列说法一定正确的是( )
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
A
解析

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列叙述正确的是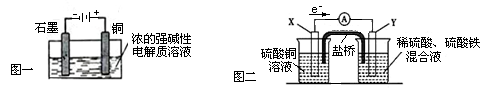
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
| A.甲装置是原电池,乙装置是电解池 |
| B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g |
| C.实验一段时间后,甲烧杯中溶液的pH增大 |
| D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置 |
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )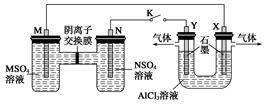
| A.溶液中c(M2+)减小 |
| B.N的电极反应式:N=N2++2e- |
| C.X电极上有H2产生,发生还原反应 |
| D.反应过程中Y电极周围生成白色胶状沉淀 |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是( )
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2↓ |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是( )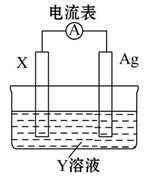
| A.电解质溶液Y是CuSO4溶液 |
| B.电极X的材料是Cu |
| C.银电极为电池的正极,其电极反应为Ag++e-=Ag |
| D.外电路中的电子是从X电极流向Ag电极 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOClCl)中形成的,其电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是( )
| A.电解质溶液可以用水,也可以用饱和食盐水 |
| B.电池工作过程中,亚硫酰氯(SOCl2)被还原成Li2SO3 |
| C.电池工作时,锂电极为正极,石墨电极为负极 |
| D.电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1 |
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大:
| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.25 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
