题目内容
5.下列互为同分异构体的是( )| A. | O2与O3 | B. | 乙醇与二甲醚 | C. | CH4与C2H6 | D. | 红磷与白磷 |
分析 具有相同分子式而结构不同的化合物互为同分异构体;
有机化合物中具有同一通式、组成上相差一个或多个CH2原子团、在结构与性质上相似的化合物互为同系物;
同素异形体是同种元素形成的不同单质.
解答 解:A.O2与O3为同种元素组成的不同单质,二者互为同素异形体,不属于同分异构体,故A错误;
B.乙醇的分子式为C2H6O,二甲醚的分子式为C2H6O,分子式相同、结构不同,二者互为同分异构体,故B正确;
C.CH4与C2H6结构相似,分子间相差1个CH2原子团,二者互为同系物,故C错误;
D.红磷与白磷为同种元素组成的不同单质,二者互为同素异形体,故D错误;
故选B.
点评 本题考查了同分异构体的判断和理解,掌握物质的化学式是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.分子式为C10H14的可能结构中只有一个取代基且含有苯环的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
20.下列说法正确的是( )
| 元素 | 有关信息 |
| X | 所在主族序数与所在周期序数之差为4,在该周期中原子半径最小 |
| Y | 在最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W | 地壳中含量最高的金属元素 |
| A. | W与Y的最高价氧化物对应的水化物之间可相互反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rW | |
| C. | 向浓ZX3溶液中滴加少量的Na2SO3溶液,可产生大量沉淀和气体 | |
| D. | 可用电解W与X形成的化合物来制取W单质 |
7.X,Y,Z,W为原子序数依次增大的四种短周期元素,它们分别处在两个周期,Y和W同主族,化合物ZW2的水溶液显酸性,X和Z可疑构成离子化合物ZX,下列说法错误的是( )
| A. | 离子半径:X2->Y->Z2+ | |
| B. | 单质的熔点:Z>W>Y | |
| C. | 能破坏水的电离平衡的离子为:Y-,Z2+,W- | |
| D. | 离子化合物ZX的熔点高,ZX可作为耐火材料 |
10.下列有关溶液配制的说法正确的是( )
| A. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| B. | 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L-1K2Cr2O7溶液 | |
| C. | 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸 | |
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
14.某冶炼厂以碳棒作电极,电解熔融状态的Al2O3,生成的氧气同时还与阳极碳棒反应生成CO和CO2,当生成54kg铝时,阳极消耗24kg碳,则阳极生成的CO和CO2中,CO和CO2的分子个数比为( )
| A. | 1﹕3 | B. | 1﹕2 | C. | 1﹕1 | D. | 2﹕1 |
15.氧化还原反应的实质和相应的规律是( )
| A. | 化合价的升降,化合价的升高和降低的总数相等 | |
| B. | 电子的转移,得电子总数和失电子总数相等 | |
| C. | 得氧和失氧,氧原子数目不变 | |
| D. | 物质的种类发生改变,质量守恒定律 |
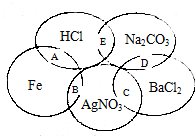 如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题: