题目内容
14.某冶炼厂以碳棒作电极,电解熔融状态的Al2O3,生成的氧气同时还与阳极碳棒反应生成CO和CO2,当生成54kg铝时,阳极消耗24kg碳,则阳极生成的CO和CO2中,CO和CO2的分子个数比为( )| A. | 1﹕3 | B. | 1﹕2 | C. | 1﹕1 | D. | 2﹕1 |
分析 n(Al)=$\frac{54000g}{27g/mol}$=2000mol,n(C)=$\frac{24000g}{12g/mol}$=2000mol,电解时,阳极上C失电子,阴极上Al3+得电子,根据转移电子守恒、C原子守恒计算生成CO和CO2的分子个数比.
解答 解:n(Al)=$\frac{54000g}{27g/mol}$=2000mol,n(C)=$\frac{24000g}{12g/mol}$=2000mol,电解时,阳极上C失电子,阴极上Al3+得电子,
设CO和CO2的物质的量分别是xmol、ymol,
根据转移电子守恒、C原子守恒列方程组为:
$\left\{\begin{array}{l}{x+y=2000}\\{2x+4y=2000×3}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=1000}\\{y=1000}\end{array}\right.$
根据N=nNA知分子个数与其物质的量成正比,二者物质的量相等,则分子个数相等,分子个数之比为1:1,
故选C.
点评 本题考查电解原理,为高频考点,明确转移电子守恒、原子守恒是解本题关键,注意:Al的冶炼采用电解熔融氧化铝方法,不能采用电解熔融氯化铝方法,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
11.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法不正确的是( )

| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |
5.下列互为同分异构体的是( )
| A. | O2与O3 | B. | 乙醇与二甲醚 | C. | CH4与C2H6 | D. | 红磷与白磷 |
2.下列说法中错误的是( )
| A. | 3-甲基戊烷的一氯代产物有4种 | |
| B. | 光照下2,2-二甲基丙烷与Br2反应其一溴取代物只有一种 | |
| C. | 分子式为C5H10O2的酯共有9种 | |
| D. | 分子式为C8H10的芳香烃有3种同分异构体 |
9.Ⅰ.实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定.具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定.(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4~5之间,那么指示剂宜选,当滴定至溶液由黄 色变成橙色时,即表示到达终点;
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手,两眼注视,直到滴定终点.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:.
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度.
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手,两眼注视,直到滴定终点.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:.
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
19.X、Y、Z三种短周期元素在周期表中的位置如表所示.若X的最高正价与最低负价的代数和为2,则下列说法正确的是( )
| X | Z | |
| Y |
| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Y | |
| C. | X的最高价氧化物对应的水化物的稀溶液能与铜发生反应 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
6.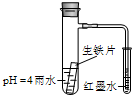 如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
 如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 墨水回升时,生铁片发生吸氧腐蚀 | |
| C. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| D. | 具支试管中溶液pH逐渐减小 |
3.下列说法正确的是( )
| A. | CO(g)的燃烧热:△H=-283.0KJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=-556.0KJ/mol | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.30KJ/mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a; 2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 已知c(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 |
4.下列过程中,不涉及化学变化的是( )
| A. | 用明矾净化水 | |
| B. | 甘油加水作护肤剂 | |
| C. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 | |
| D. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 |