题目内容
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:

(1)装置的连接顺序为a→__________→___________→______________→_______________→b→c→f。
(2)硬质玻璃管中可观察到的现象是_________________________;硬质玻璃管与收集器之间没有用导管连接,原因是______________________________________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X的化学式为________;有同学分析淡黄色溶液中含有Fe2+,你认为__________(填“合理”或“不合理”);固体产物的成分可能是_______(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是______,加入新制氯水后溶液红色加深的原因:_____(用离子方程式表示)。
(5)某小组同学实验时在加入新制氯水后,并未得到深红色溶液,其原因可能是_________;请设计实验对你所分析的原因进行验证,简要写出实验方案:__________。
【答案】g h d e 有棕褐色烟生成 防止堵塞(其他合理答案均可) KSCN(或NH4SCN) 合理 A 隔绝空气,防止Fe2+被氧化 2Fe2++Cl2=2Fe3++2Cl- 新制氯水将SCN-氧化 取少许该小组同学实验后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立(或其他合理答案)
【解析】
(1)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理;
(2)Fe在氯气中燃烧生成棕褐色烟,导气管口较细,易堵塞;
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;Fe和稀盐酸、氯化铁反应生成FeCl2;
(4)Fe2+不稳定而易被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大。
(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,
故答案为:g;h;d;e;
(2)Fe在氯气中燃烧生成棕褐色烟,所以看到的现象是有棕褐色烟生成;棕褐色烟冷却易生成固体,导气管口较细,易堵塞,所以硬质玻璃管与收集器之间没有用导管连接,
故答案为:有棕褐色烟生成;防止堵塞(或其他合理描述都可);
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,所以试剂X为KSCN溶液;固体和氯气反应时可能没有完全反应,导致Fe和稀盐酸、氯化铁反应生成氯化亚铁,Fe和稀盐酸反应生成FeCl2,所以分析合理,固体中成分为Fe和FeCl3,
故答案为:KSCN(或NH4SCN);合理;A;
(4)Fe2+不稳定,易被空气中氧气氧化,所以植物油的作用是隔绝空气防止Fe2+被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,涉及的反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:隔绝空气,防止Fe2+被氧化;2Fe2++Cl2=2Fe3++2Cl-;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大,则可能原因是新制氯水将SCN-氧化;
其检验方法是:取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立,
故答案为:新制氯水将SCN-氧化;取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
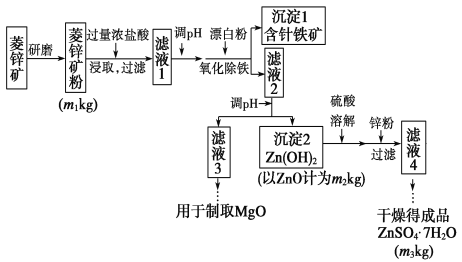
(1)完成“氧化除铁”步骤中反应的离子方程式:
(_________)Fe(OH)2+(________)________+(_________)______===(________)Fe(OH)3+(_________)Cl-
(2)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是________。
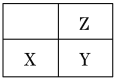
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp mol3·L-3 | 5.6×10-12 | — | 6.8×10-10 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰粉 c.纯碱溶液 d.烧碱溶液
(5)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________________。