题目内容
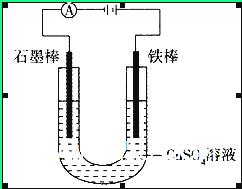
如图装置,U形管中装有50 mL 2 mol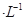 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是
 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是
| A.转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B.转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C.电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D.若将石墨棒换成铜棒,可实现铁制品上镀铜 |
B
试题分析:该电池中硫酸铜的总的物质的量为0.2mol ,可以电离出0.1mol 的铜离子。在阴阳两个电极上分别发生的反应为:阳极:Fe-2e-=Fe2+ 阴极:Cu2++2e-=Cu 但是当溶液中的铜离子反应完全之后,就该溶液中由水电离出半的氢离子放电:2H++2e-=H2,因此A、转移0.2 mol电子时,阳极减少质量为5.6g,小于阴极增加质量6.4g,错误;B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体-氢气,正确;C、电解一段时间后,U形管中左端碳棒上会产生红褐色物质,后来也不溶解,错误;D、若将石墨棒换成铜棒,可实现铜的精制,而不是铁上镀铜,错误。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
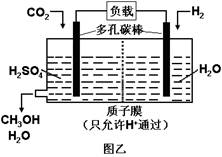
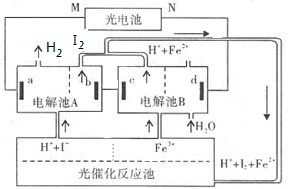
 2Fe2+ + I2
2Fe2+ + I2 L·mol -1
L·mol -1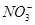 )=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是