题目内容
11.下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③ | |
| C. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
分析 A、根据电荷守恒来分析;
B、①NH4HCO3溶液中发生双水解、②NH4Cl溶液中为单水解、③NH4HSO4中铵根离子的水解被抑制;
C、0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后,所得溶液为浓度均为0.025mol/L的CH3COONa、CH3COOH和NaCl的混合溶液,根据电离大于水解来分析;
D、根据物料守恒来分析.
解答 解:A、某二元弱酸的酸式盐NaHA溶液中,HA-既能电离又能水解,故根据电荷守恒可有:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故A错误;
B、①NH4HCO3溶液中发生双水解,铵根离子的水解被促进,②NH4Cl溶液中为单水解,③NH4HSO4中铵根离子的水解被抑制,故c(NH4+)的大小关系:①<②<③,故B错误;
C、0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后,所得溶液为浓度均为0.025mol/L的CH3COONa、CH3COOH和NaCl的混合溶液,此溶液中c(Cl-)=0.025mol/L,由于CH3COOH的电离大于CH3COONa的水解程度,故溶液显酸性,且c(CH3COO-)>c(Cl-)>c(CH3COOH),故有:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故C正确;
D、0.1mol•L-1(NH4)2Fe(SO4)2溶液中,铵根离子和亚铁离子均存在水解,分别部分水解为一水合氨和氢氧化亚铁,根据物料守恒可知:c(NH4+)+c(NH3•H2O)+c(Fe2+)+c[Fe(OH)2]=0.3 mol•L-1,故D错误;
故选C.
点评 本题考查了盐类水解中离子浓度大小比较和三个守恒,难度适中,综合性较强,应注意的是三个守恒的书写.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 在强碱性溶液中,[Al(OH)4]-、HCO3-、Na+、Ca2+可能同时大量共存 | |
| C. | 铁船底镶嵌锌块,构成原电池,锌作负极,以防船体被腐蚀 | |
| D. | 用量筒量取10.mL 1.0mol/L的盐酸于100mL溶液瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
| A. | Al3+、Na+、Cl-、SiO32- | B. | Fe3+、Ba2+、I-、NO3- | ||
| C. | NH4+、K+、S2-、SO32- | D. | H+、Ca2+、F-、Br- |
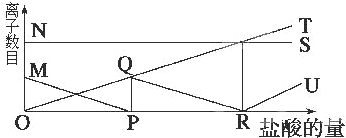
| A. | NS:K+; MP:H+; QR:CO32-; OT:HCO3-; RU:Cl- | |
| B. | NS:K+; MP:CO32-; OQR:HCO3-; OT:Cl-; RU:H+ | |
| C. | NS:K+; MP:Cl-; QR:H+; OT:HCO3-; RU:CO32- | |
| D. | NS:K+; MP:H+; OQR:Cl-; OT:C32-; RU:HCO3- |
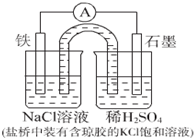
| A. | Fe作正极,发生氧化反应 | |
| B. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| C. | 正极反应:2H++2e-=H2↑ | |
| D. | 工作一段时间后,NaCl溶液中c(Na+ )增大 |
| A. | 当$\frac{a}{b}$>2时,发生的离子反应为:CO32-+H+═HCO3-,HCO3-+H+═CO2↑+H2O | |
| B. | 当0<$\frac{a}{b}$<1时,发生的离子反应为:CO32-+H+═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:2CO32-+3H+═HCO3-+CO2↑+H2O | |
| D. | 当1<$\frac{a}{b}$<2时,溶液中n(HCO3-)为(2a-b)mol |
