题目内容
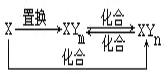
【题目】(14分)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为 ,反应的离子方程式为 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
【答案】(1)Fe2O3+3CO![]() 2Fe+3CO2 (2) 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
2Fe+3CO2 (2) 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
(3)防止NH4HCO3分解
(4)KCl 2K++SO42-=K2SO4↓ (5) 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(6)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液
【解析】
试题分析:(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,因此该气体是CO,则该气体与Fe2O3反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)亚铁离子具有还原性,易被空气中的氧气氧化,因此若在空气中酸浸时间过长,溶液中Fe2+含量将下降,反应的离子方程式为4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O;
(3)碳酸氢铵是弱酸的铵盐,受热易分解,所以温度不能超过35℃的原因是防止NH4HCO3分解;
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X中一定含有钾离子,因此X可以是氯化钾,反应的离子方程式为2K++SO42-=K2SO4↓;
(5)在空气中煅烧,碳酸亚铁被氧化为氧化铁,同时还有CO2生成,反应的方程式为4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(6)产品Ⅱ主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu2(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A. A B. B C. C D. D