题目内容
根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂__________,还原剂____________
(2)用双线桥法标明电子转移的方向和数目
8NH3 + 3Cl2 = 6NH4Cl + N2
(1)氧化剂__________,还原剂____________
(2)用双线桥法标明电子转移的方向和数目
8NH3 + 3Cl2 = 6NH4Cl + N2
(4分)Cl2 NH3 (每空1分)
 (2分)
(2分)
 (2分)
(2分)试题分析:8NH3+3Cl2=6NH4Cl+N2 氧化剂是氯气;还原剂是氨气;
用双线桥法标明电子转移的方向和数目如下:

点评:解答氧化还原反应的问题时依据的规律为:氧化剂得电子,化合价降低,还原剂失电子,化合价升高。

练习册系列答案
相关题目
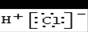

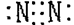
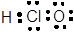

 FeCl2
FeCl2