题目内容
(11分)直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。
⑴利用钠碱循环法可脱除烟气中的SO2。
①用化学方程式表示SO2形成硫酸型酸雨的反应:
。
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反
应的离子方程式是_________ 。
⑵处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
。
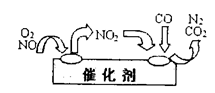
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出净化过程中的总化学反应方程式:
。
③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O。某工厂排出的尾气中NOx的含量为0.56%(体积分数), 若处理1×104L(标准状况)该尾气需42.5gNH3,则x= 。
⑴利用钠碱循环法可脱除烟气中的SO2。
①用化学方程式表示SO2形成硫酸型酸雨的反应:
。
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反
应的离子方程式是_________ 。
⑵处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出净化过程中的总化学反应方程式:
。

③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O。某工厂排出的尾气中NOx的含量为0.56%(体积分数), 若处理1×104L(标准状况)该尾气需42.5gNH3,则x= 。
(1)①SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4(2分)
②SO2+2OH¯=SO2-3+H2O(2分)
⑵①NaNO3(2分)②2NO+O2+4CO 4CO2+N2(2分)③1.5(3分)
4CO2+N2(2分)③1.5(3分)
②SO2+2OH¯=SO2-3+H2O(2分)
⑵①NaNO3(2分)②2NO+O2+4CO
 4CO2+N2(2分)③1.5(3分)
4CO2+N2(2分)③1.5(3分)试题分析:(1)①酸雨的形成主要是由于空气中的SO2溶于雨水形成的。发生的反应为:SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4。②SO2与NaOH溶液反应的离子方程式为:SO2+2OH¯=SO2-3+H2O。
(2)①发生反应的化学方程式为:2NaOH+2NO2=NaNO2+NaNO3+H2O。因此另一种溶质为NaNO3。②发生反应的化学方程式为:2NO+O2+4CO
 4CO2+N2。
4CO2+N2。③1×104L(标准状况)该尾气中
 ,42.5gNH3的物质的量
,42.5gNH3的物质的量 ,由化学方程式可得比例式:
,由化学方程式可得比例式: ,解得
,解得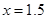 。
。点评:本题属于基础题,考生必须掌握。在书写化学方程式时,应注意配平。

练习册系列答案
相关题目
 H3O++ CO32-
H3O++ CO32- H2O+ CO2+2OH-
H2O+ CO2+2OH-
 Al2O3+H2O。从而降低可燃物温度达到着火点以下,达到阻燃的目的。该反应属于( )
Al2O3+H2O。从而降低可燃物温度达到着火点以下,达到阻燃的目的。该反应属于( )