��Ŀ����
����Ŀ����֪A��B��C��D����ѧ��ѧ�������ʣ�������һ����������A+B��C+D��ת����ϵ��
��1����AΪ��������BΪ���������÷�Ӧ��һ����;�� ��
��2����A��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬�Ҹ÷�Ӧ�ǹ�ҵ����ȡ�������Ҫ��Ӧ֮һ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ ��
��3����A�ǵ���ɫ��ĩ����������������CΪǿ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ ��
��4����A��B��D�����л����������A��B�Ǽ�ͥ�����г�����ζƷ����Ҫ�ɷ֣���A ����Է���������B��14��
�ٸ÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ ��
��ij����BΪ��Ӧ������͵��������ʾ���õ�صĸ����ĵ缫��ӦʽΪ ��
��5��ClO2�ɽ������Է�ˮ�е�Mn2+ת��ΪMnO2����ȥ��ͬʱClO2����ԭΪCl�� �� �÷�Ӧ�����ӷ���ʽΪ �� 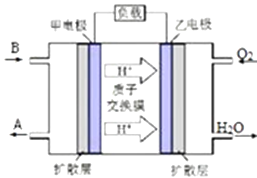
���𰸡�
��1�����Ӹֹ�
��2��4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
��3��2Na2O2+2H2O=4NaOH+O2��
��4��CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O��C2H5OH��4e��+H2O=CH3COOH+4H+
CH3COOC2H5+H2O��C2H5OH��4e��+H2O=CH3COOH+4H+
��5��2ClO2+5Mn2++6H2O=5MnO2��+2Cl��+12H+
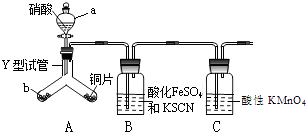
���������⣺��1.�����������£������������������ȷ�Ӧ���ų������ȶ�ʹ�����ڣ����������ں��Ӹֹ죬���Դ��ǣ����Ӹֹ죻
��2.����A��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬�Ҹ÷�Ӧ�ǹ�ҵ����ȡ�������Ҫ��Ӧ֮һ����A�ǰ����������ڴ����������������ܺ�������Ӧ����NO��ˮ����Ӧ����ʽΪ4NH3+5O2 ![]() 4NO+6H2O�����Դ��ǣ�4NH3+5O2
4NO+6H2O�����Դ��ǣ�4NH3+5O2 ![]() 4NO+6H2O��
4NO+6H2O��
��3.����A�ǵ���ɫ��ĩ������������������A�ǹ������ƣ�CΪǿ�ΪNaOH����B��ˮ��DΪ���������ݷ�Ӧ�����������д����ʽΪ2Na2O2+2H2O=4NaOH+O2�������Դ��ǣ�2Na2O2+2H2O=4NaOH+O2����
��4.����A��B��D�����л����������A��B�Ǽ�ͥ�����г�����ζƷ����Ҫ�ɷ֣���A����Է���������B��14��A�ܺ�B��Ӧ����C��D��AΪ���ᡢBΪ�Ҵ�������Ũ���������������������£�������Ҵ�����������Ӧ����Ӧ����ʽΪCH3COOH+C2H5OH ![]() CH3COOC2H5+H2O�����Դ��ǣ�CH3COOH+C2H5OH
CH3COOC2H5+H2O�����Դ��ǣ�CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O���ڸ�ȼ�ϵ���У��������Ҵ�ʧ���ӷ���������Ӧ���õ������Һ�����ԣ��������������ӺͶ�����̼���缫��ӦʽΪC2H5OH��4e��+H2O=CH3COOH+4H+ �� ���Դ��ǣ�C2H5OH��4e��+H2O=CH3COOH+4H+��
CH3COOC2H5+H2O���ڸ�ȼ�ϵ���У��������Ҵ�ʧ���ӷ���������Ӧ���õ������Һ�����ԣ��������������ӺͶ�����̼���缫��ӦʽΪC2H5OH��4e��+H2O=CH3COOH+4H+ �� ���Դ��ǣ�C2H5OH��4e��+H2O=CH3COOH+4H+��
��5.��ClO2�ɽ������Է�ˮ�е�Mn2+ת��ΪMnO2����ȥ��ͬʱClO2����ԭΪCl�� �� ���ݷ�Ӧ��������Pת�Ƶ����غ���д���ӷ���ʽΪ2ClO2+5Mn2++6H2O=5MnO2��+2Cl��+12H+ �� ���Դ��ǣ�2ClO2+5Mn2++6H2O=5MnO2��+2Cl��+12H+ ��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ�����º����£���2L�ܱ������м���MgSO4��s����CO��g����������Ӧ��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g������Ӧ�����вⶨ�IJ������������
��Ӧʱ��/min | n��MgSO4��/mol | n��CO��/mol | n��SO2��/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
����˵����ȷ���ǣ� ��
A.0��2 min�ڵ�ƽ������Ϊ�� ��CO��=0.6 mol/��Lmin��
B.4 min��ƽ���ƶ���ԭ��������������м�����2.0 mol��SO2
C.�������¶ȣ���Ӧ��ƽ�ⳣ����Ϊ1.0��������ӦΪ���ȷ�Ӧ
D.�����������䣬����ʼʱ������MgSO4��CO��Ϊ1.0 mol����ƽ��ʱn��SO2��=0.6 mol