题目内容
为确定某溶液的离子组成,进行如下实验:
①常温下,测定溶液的pH溶液呈强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;③在②反应后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取上层清液继续滴加 Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验,以下对原溶液中大量存在的离子的推测正确的是
| A.一定含SO32- | B.一定含CO32- | C.C1-一定存在 | D.不能确定HCO3-是否存在 |
B
解析试题分析:①测定溶液的pH,溶液显强碱性,说明溶液中含有氢氧根离子,碳酸氢根离子不能存在;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体,说明生成的气体为二氧化碳,不是刺激性气味的二氧化硫,说明原溶液中含碳酸根离子;③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.进一步证明溶液中含碳酸根离子;④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀说明含氯离子,但②步中加入盐酸含有氯离子,不能确定原溶液中含氯离子。综上所述:溶液中一定含碳酸根离子,一定不含亚硫酸根离子、碳酸氢根离子,氯离子不能确定,答案选B。
考点:考查离子共存、离子检验等

下列离子在指定溶液中一定能大量共存的是
①加入Al能放出H2的溶液中:SO42-、Na+、K+、Cl-
②中性溶液:Mg2+、Fe3+、SO42-、Cl-(已知Ksp[Fe(OH)3]=2.6×10-39)
③由水电离的c(H+)=10-12mol/L的溶液中:Na+、K+、SO42-、HCO3-
④能使紫色石蕊变红的溶液中:Fe2+、NO3-、I-、Al3+
| A.③④ | B.②④ | C.①② | D.只有① |
下列反应的离子方程式书写正确的是
| A.在澄清石灰水中加入少量小苏打:Ca2++CH-+HCO3- |
| B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O |
| D.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2 |
下列方程式正确的是( )
A.用氯胺处理自来水:NH2Cl+H2O NH2OH+HCl NH2OH+HCl |
| B.在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水: Ca2+ +Mg2+ +2OH- +2HCO3-=CaCO3↓+MgCO3↓+2H2O |
C.长时间煮沸含Mg2+、HCO3-的自来水:Mg2+ +2HCO3-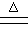 Mg(OH)2↓+2CO2↑ Mg(OH)2↓+2CO2↑ |
| D.Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为: |
下列离子方程式正确的是
| A.钠溶于水:2Na+H2O=2Na++OH-+H2↑ |
| B.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO3-=SO2↑+H2O |
| D.向0.1mol·L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
下列物质的水溶液均能导电,但属于非电解质的是
| A.SO2 | B.Cl2 | C.MgSO4 | D.KOH |
下列各组离子在指定溶液中一定能大量共存的是
| A.发生析氢腐蚀的溶液中:NH4+、Ba2+、AlO2-、Cl- |
| B.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| D.甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
下列相关反应的离子方程式书写错误的是
| A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4: 3ClO- +4OH- +2Fe(OH)3=3Cl- +5H2O+2FeO2- 4 |
| B.少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO2- 3 |
| C.用稀硫酸酸化的KMnO4溶液与H2O2反应:2MnO- 4+6H++5H2O2=2Mn2++5O2↑+8H2O |
| D.SO2通入NaClO溶液中:SO2+ClO- +OH-=SO2- 4+Cl- +H+ |