��Ŀ����
����Ŀ������þ�ǿ�ѧ�����Ʊ���һ����Ҫ����������ɵ�ֱֻ�ӻ��϶��ɣ�����ˮ���õIJ���֮һΪNH3 �� ��ش��������⣺
��1��Na3N�������γɵ������д�����ĵ���ʽ�� ��
��2��Na3N��ˮ��Ӧ�������������Ӧ���ͣ���д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3��Na+��N3���İ뾶��ϵ��Na+�����������������=����N3�� ��
��4��Mg3N2������ķ�Ӧ�������Σ��õ���ʽ��ʾ����ֻ�������Ӽ����ε��γɹ��� �� д����һ���εĵ���ʽ
���𰸡�
��1�����ӣ����ӣ�![]()
��2�����ֽ⣻Na3N+3H2O=NH3��+3NaOH
��3����
��4������![]() ��
��![]()
���������⣺��1��NԪ����Na֮���γ����Ӽ��������������ӻ����������ԭ��ʧȥ�������ӣ���Nԭ�ӣ�ʹNԭ�������ﵽ�ȶ��ṹ�������ʽΪ�� ![]() �� ���Դ��ǣ����ӣ����ӣ�
�� ���Դ��ǣ����ӣ����ӣ� ![]() ����2����������ˮ��Ӧ����NH3��һ��ǿ����ݷ�Ӧ����ʽ���ص㣬ǿ��ֻ����NaOH���䷴Ӧ����ʽ��Na3N+3H2O=NH3��+3NaOH��ʵ����Na+���ˮ�������OH�� �� N3�����ˮ�������H+ �� �����ڸ��ֽⷴӦ��
����2����������ˮ��Ӧ����NH3��һ��ǿ����ݷ�Ӧ����ʽ���ص㣬ǿ��ֻ����NaOH���䷴Ӧ����ʽ��Na3N+3H2O=NH3��+3NaOH��ʵ����Na+���ˮ�������OH�� �� N3�����ˮ�������H+ �� �����ڸ��ֽⷴӦ��
���Դ��ǣ����ֽ⣻Na3N+3H2O=NH3��+3NaOH����3�����������ӵĺ�������Ų���ͬ����������Ų���ͬ�����Ӱ뾶��ԭ���������������С����r��Na+����r��N3���������Դ��ǣ�������4������þ���ᷴӦ�����Ȼ�þ���Ȼ�泥�MgCl2�������ӻ����þ����������������ͨ�����Ӽ���ϣ�MgCl2�������ӻ����Mg������������ӱ�����Clԭ�ӵõ����õ���ʽ��ʾ�γɹ���Ϊ ![]() ���Ȼ�������ӻ�����ɰ��������������ӹ��ɣ�����ʽΪ��
���Ȼ�������ӻ�����ɰ��������������ӹ��ɣ�����ʽΪ�� ![]() ��
��
���Դ��ǣ����� ![]() ��
�� ![]() ��
��

����Ŀ����ͼ��ʾװ���У��۲쵽������ָ��ƫת��M����֣�N����ϸ���ɴ��жϱ�������M��N��P���ʣ����п��Գ������ǣ� ��
M | N | P | |
A | Zn | Cu | ϡH2SO4��Һ |
B | Cu | Fe | ϡHCl��Һ |
C | Ag | Zn | AgNO3��Һ |
D | Zn | Fe | Fe��NO3��3��Һ |

A.A
B.B
C.C
D.D
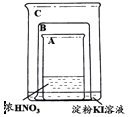
����Ŀ��ijͬѧ��������ʵ�飺����˵���������ǣ� ��
װ�� | ���� | ���� |
| ��ʢ��Ũ������ձ�A����ʢ�е���KI��Һ���ձ�C�У�Ȼ��ͭƬ�����ձ�A���������ձ�B��ס | �ձ�AҺ���Ϸ��������ִ�������ɫ���壻һ��ʱ�����ɫ������ʧ���ձ�A��C�е�Һ�嶼�����ɫ |
A.�ձ�A�з�����Ӧ��3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O
B.����ɫ������ʧֻ��NO2���ձ�C�е�KI������Ӧ�й�
C.�ձ�C����Һ����ֻ��NO2��C����Һ������Ӧ�й�
D.����ͭƬ������Ƭ����C�е�Һ��Ҳ���ܱ���