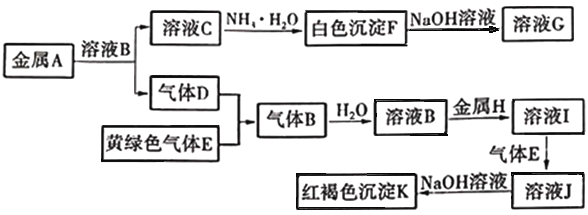
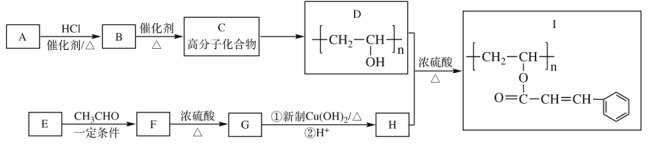
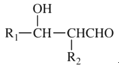
题目内容
【题目】常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系正确的是

A.a点:c(H+)>c(Cl-)>c(ClO-)
B.b点:c(Cl-)=c(SO42-)=0.005mol·L-1
C.c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)
D.d点:c(Na+)=c(Cl-)+2c(SO32-)+2c(SO42-)
【答案】A
【解析】
A.a点为氯水,氯气和水反应生成HCl和HClO,HCl完全电离、HClO部分电离,则离子浓度大小为:c(H+)>c(Cl-)>c(HClO)>c(ClO-),故A正确;
B.b点是滴入亚硫酸钠和氯水中氯气恰好反应生成硫酸钠和盐酸:Na2SO3+Cl2+H2O=Na2SO4+2HCl,氯离子和硫酸根离子不水解,pH=2时氢离子浓度为0.01mol/L,则![]() c(Cl-)=c(SO42-)=0.005 molL-1,故B错误;
c(Cl-)=c(SO42-)=0.005 molL-1,故B错误;
C.c点含剩余少量HCl,生成氯化钠,溶质为氯化钠、亚硫酸、硫酸钠,溶液中还含有氯离子,则c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)不成立,故C错误;
D.d点pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(Cl-)+2c(SO32-)+c(HSO3-)+2c(SO42-),故D错误;
答案选A。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
【题目】Ⅰ.某一溴代烷与浓NaOH的醇溶液共热时产生3种沸点不同的消去产物,该一溴代烷至少应含有________个碳原子,其中一种结构简式可表示为____________。
Ⅱ.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
Ⅲ.有机物A分子式为C3H6O2,把它进行实验并记录现象如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
A的结构简式为:_____________
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。