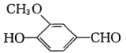
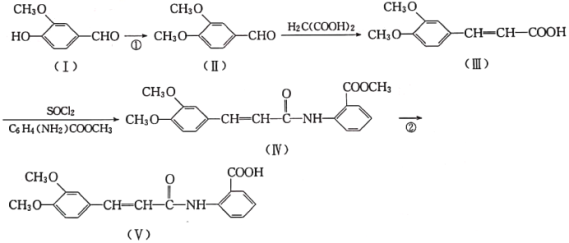
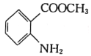
题目内容
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
【答案】10mL量筒 0.12g 两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好 B 调节量筒高度,使量筒内的液面与集气瓶内的液面相平 0.2VLmol﹣1 偏小
【解析】
②量取10.0mL1.0molL1的盐酸,选用10mL量筒即可,
故答案为:10mL量筒。
③根据方程式:
Mg+2HCl═MgCl2+H2↑
24g 2mol
a 0.01mol
a=![]() g=0.12g;
g=0.12g;
故答案为:0.12g。
(1)根据压力差检验装置的气密性,两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好。
故答案为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好。
(2)步骤③假设a全部是镁,则
Mg+2HCl═MgCl2+H2↑
24g 2mol 22400mL
0.12g 0.01mol 112mL
由方程可知:为使HCl全部参加反应,a的数值至少为0.12g;生成112mL氢气,应选200mL量筒;读数时要保持左右气体压强相等,以减少误差,故应注意:将量筒缓缓向下移动,使乙、丙中液面相平,调节量筒高度,使量筒内的液面与集气瓶内的液面相平;
故答案为:B;调节量筒高度,使量筒内的液面与集气瓶内的液面相平;
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=![]() =0.2VLmol1;若未除去镁条表面的氧化膜,生成的氢气体积减少,则测量结果偏低;
=0.2VLmol1;若未除去镁条表面的氧化膜,生成的氢气体积减少,则测量结果偏低;
故答案为:0.2VLmol1;偏小。

 阅读快车系列答案
阅读快车系列答案