题目内容
【题目】N2和H2在催化剂表面合成氨气反应的能量变化如图,下列说法正确的是
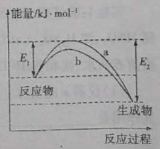
A.相同条件下,催化剂b的效果更好
B.使用催化剂,合成氨反应放出的热量减少
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
【答案】A
【解析】
A.由图像可知,加入催化剂b时,反应的活化能更低,所以相同条件下,催化剂b的效果更好,A选项正确;
B.催化剂不改变反应的热效应,即使用催化剂,合成氨反应放出的热量不变,B选项错误;
C.由图像可知,合成氨的反应是放热反应,反应物断键吸收的能量小于生成物形成新键释放的能量,C选项错误;
D.催化剂在吸附N2、H2时,没有形成化学键,即催化剂与气体之间的作用力不属于化学键,D选项错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
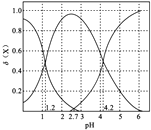
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
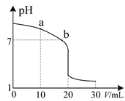
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如下。
变化如下。
序号 |
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
| p>② | 方法II |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①、②、③的化学平衡常数的关系:![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①前20min的平均反应速率![]()


