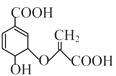
题目内容
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气和烧碱等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
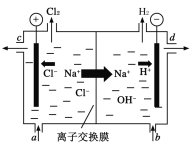
(1)电解饱和食盐水的离子方程式为___。
(2)氢氧化钠溶液从图中___(填“a”、“b”、“c”或“d”)位置流出。
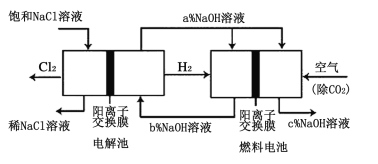
(3)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。通入氢气的电极的电极反应式为___,燃料电池中阳离子的移动方向___(“从左向右”或“从右向左”)。电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为___。a、b、c的大小关系为___。
【答案】2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ d 负极 从左向右 1mol c>a>b
2OH-+H2↑+Cl2↑ d 负极 从左向右 1mol c>a>b
【解析】
(1)电解饱和食盐水生成氢氧化钠、氢气和氯气;
(2)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大;
(3)分析题给装置图知,该装置是以碱性氢氧燃料电池电解饱和食盐水的装置。
(1)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;
(3)根据燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,正极是氧气发生得电子得还原反应,则通氢气的电极为负极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,从左向右;
电解池中产生2mol Cl2,依据电子守恒,结合电极反应式O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,计算得到消耗氧气1mol;
燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b。