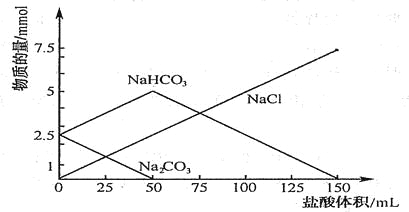
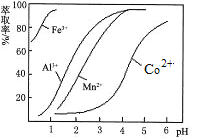
题目内容
【题目】一种以2mol/L Na2SO4水溶液为电解质的钠离子电池的总反应如下:NaTi2(PO4)3 +Zn+ Na2SO4![]() Na3Ti2(PO4)3 +ZnSO4。其中P的化合价为+5,下列有关说法正确的是( )
Na3Ti2(PO4)3 +ZnSO4。其中P的化合价为+5,下列有关说法正确的是( )
A.放电时,NaTi2(PO4)3发生氧化反应
B.放电时,钠离子向负极移动
C.充电时,阳极反应式为:Zn-2e- =Zn2+
D.充电时,每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3
【答案】D
【解析】
试题分析:A.放电时,化合价降低的Ti元素所在的反应物NaTi2(PO4)3发生还原反应,Ti元素的化合价由+4价变为Na3Ti2(PO4)3中的+3价,错误;B.原电池中,电解质里的阳离子移向正极,阴离子移向负极,所以钠离子移向正极,错误;C.充电时,阳极上发生失电子的氧化反应:Ti2(PO4)3 -2e-=Ti2(PO4)33 -,错误;D.根据电池反应:NaTi2(PO4)3 +Zn+ Na2SO4![]() Na3Ti2(PO4)3 +ZnSO4可知,若转移电子是2mol,即每移动2mol电子,消耗1mol Na3Ti2(PO4)3,所以每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3,正确。
Na3Ti2(PO4)3 +ZnSO4可知,若转移电子是2mol,即每移动2mol电子,消耗1mol Na3Ti2(PO4)3,所以每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3,正确。

练习册系列答案
相关题目