题目内容
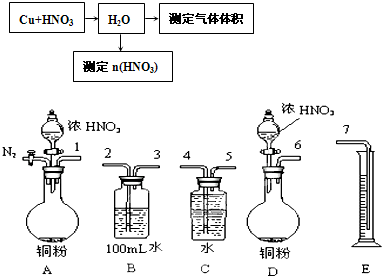
(14分)某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
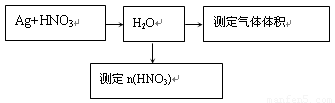
(1)测定NO的体积:
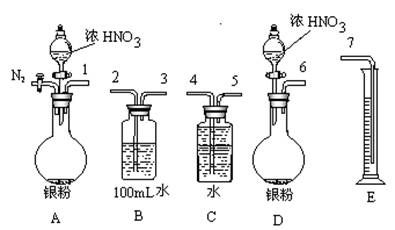
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:
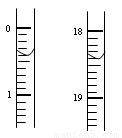
|
|
滴定前读读数/mL |
滴定后读数/mL |
|
第一次 |
|
|
|
第二次 |
0.10 |
18.00 |
|
第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
(1)① A(2分) ② 5—4→7 (2分,有错误即零分)③升高(2分)
(2)0.40(1分) 18.40(1分) 7.2×10-3 (3分)
(3)有(1分) 由3NO2 + H2O = 2HNO3 + NO生成7.2×10-3 mol HNO3同时生成3.6×10-3 mol NO,标准状况下体积为80.64mL,小于实验测得的93.0mL,所以Ag与浓硝酸反应的过程中生NO。(2分,“80.64mL”1分,表述出“80.64mL< 93.0mL” 1分)
【解析】

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案

 某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).
某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).