题目内容
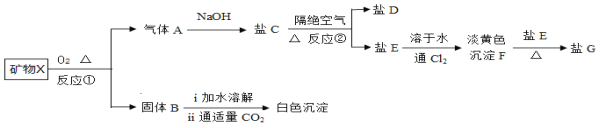
【题目】某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究。

下列有关说法不正确的是:
A. 由Ⅰ可知X中一定存在Fe2O3、Cu B. 无法判断,混合物中是否含有Al2O3
C. 原混合物中m(Fe2O3) : m(Cu) = 1:1 D. 1.92g固体成分为Cu
【答案】BC
【解析】试题分析:途径a.10.4gX与过量盐酸反应生成蓝色溶液和固体,蓝色是铜离子的盐酸,由于Cu与盐酸不反应,因此固体中一定含有Fe2O3,Fe2O3与HCl反应生成Fe3+,Fe3+再与Cu发生氧化还原反应生成Fe2+和Cu2+;4.92g固体与过量的NaOH反应,并过滤,得到1.92g固体,则减少了3g固体,为SiO2,剩余的固体为Cu。途径b.10.4gX与过量NaOH反应,过滤剩余6.4g固体,则减少了4g固体,其中有3g为SiO2,则剩余1g为Al2O3,以此来解答问题。
A.由Ⅰ可知,固体与过量的HCl反应生成蓝色溶液,则溶液中一定含有铜离子,而Cu与HCl不反应,因此固体中一定含有Fe2O3,Fe2O3与HCl反应生成Fe3+,Fe3+再与Cu发生氧化还原反应生成Fe2+和Cu2+,故A正确;
B.根据以上分析,结合途径a和途径b可知,混合物中既有SiO2,又有Al2O3,B错误;
C.设Fe2O3的物质的量为x,Cu的物质的量为y。由Fe2O3+6H+="2" Fe3++3H2O和2 Fe3++Cu="2" Fe2++ Cu2+可知,Fe2O3~2 Fe3+~Cu,故160x+64y=6.4,64y-64x=1.92,解得:x=0.02mol,y=0.05mol,故Fe2O3的质量为![]() ,Cu的质量为
,Cu的质量为![]() ,故m(Fe2O3) : m(Cu) = 1:1,C正确;
,故m(Fe2O3) : m(Cu) = 1:1,C正确;
D.由上述分析可知,1.92g固体成分为Cu,D正确;故答案B。

【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数