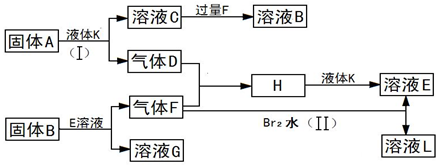
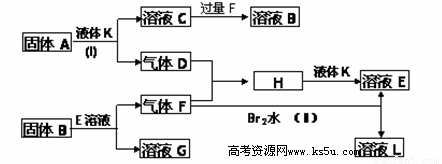
题目内容
甲、乙、丙、丁四种短周期主族元素,它们的价电子数依次增大,乙形成的化合物种类最多,甲与乙的原子序数之和等于丁的原子序数,丙和乙位于同一周期,丁和乙位于不同周期。则下列说法中正确的是
- A.甲、乙、丙形成的化合物既有离子键又有共价键
- B.乙、丙、丁形成的氢化物常温下均为气体
- C.原子序数由小到大顺序为:甲<乙<丙<丁
- D.原子半径大小顺序为:丁>甲>乙>丙
A
试题分析:乙形成的化合物种类最多,则乙是碳元素。甲与乙的原子序数之和等于丁的原子序数,丙和乙位于同一周期,丁和乙位于不同周期,因此丙是第二周期元素,丁是第三周期元素。甲、乙、丙、丁四种短周期主族元素,它们的价电子数依次增大,所以丁只能是S和Cl。则甲的原子序数只能是10或11,10号元素是稀有气体,不符合,因此甲是Na,丁是Cl,丙是N或O。
A、甲、乙、丙形成的化合物既有离子键又有共价键,例如碳酸钠等,A正确;
B、乙、丙、丁形成的氢化物常温下不一定均为气体,例如水是液态,B不正确;
C、原子序数由小到大顺序为:乙<丙<甲<丁,C不正确;
D、原子半径大小顺序为:甲>丁>乙>丙,D不正确,答案选A。
考点:考查元素周期表的结构和元素周期律的应用
试题分析:乙形成的化合物种类最多,则乙是碳元素。甲与乙的原子序数之和等于丁的原子序数,丙和乙位于同一周期,丁和乙位于不同周期,因此丙是第二周期元素,丁是第三周期元素。甲、乙、丙、丁四种短周期主族元素,它们的价电子数依次增大,所以丁只能是S和Cl。则甲的原子序数只能是10或11,10号元素是稀有气体,不符合,因此甲是Na,丁是Cl,丙是N或O。
A、甲、乙、丙形成的化合物既有离子键又有共价键,例如碳酸钠等,A正确;
B、乙、丙、丁形成的氢化物常温下不一定均为气体,例如水是液态,B不正确;
C、原子序数由小到大顺序为:乙<丙<甲<丁,C不正确;
D、原子半径大小顺序为:甲>丁>乙>丙,D不正确,答案选A。
考点:考查元素周期表的结构和元素周期律的应用

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 已知甲、乙、丙、丁四种短周期元素在周期表中的位置如图所示,则下列说法中不正确的是( )
已知甲、乙、丙、丁四种短周期元素在周期表中的位置如图所示,则下列说法中不正确的是( )