题目内容
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):

试回答:
(1)A的电子式为 ;所含化学键类型为 、 。(各1分)
(2)溴元素在周期表的位置 丁元素的阴离子结构示意图为 。(各2分)
(3)反应(I)的化学方程式为 。(2分)
(4)反应(II)的离子方程式为 。(2分)
(5)含1mol C的溶液中缓慢通入15.68 L 的CO2(标况),所得溶液中溶质的物质的量之比为 (式量大的比式量小的)
(1)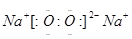 ;离子键、共价键(每空1分)
;离子键、共价键(每空1分)
(2)第四周期ⅦA族; 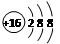 (每空2分)
(每空2分)
(3)2Na2O2+2H2O=4NaOH+O2↑(2分)
(4)SO2+Br2+2H2O=4H+ + SO42— + 2Br—(2分)
(5)3:4
【解析】
试题分析:甲和乙可形成常见液态化合物K,若K为水,则甲为氢、乙为氧。丙元素的正一价阳离子,其电子层结构与氖原子相同,故丙为钠,丁元素原子的最外层电子数是其电子层数的2倍,故为硫。由此可以推断:A为过氧化钠、K为水、C为氢氧化钠、D为氧气、F为二氧化硫、B为亚硫酸氢钠、E为硫酸、G为硫酸钠、L为氢溴酸。(1)A的电子式为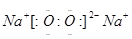 ;钠离子和过氧根形成离子键,过氧根中氧和氧形成非极性共价键;(2)溴元素在周期表的位置第四周期ⅦA族;丁元素的阴离子结构示意图为
;钠离子和过氧根形成离子键,过氧根中氧和氧形成非极性共价键;(2)溴元素在周期表的位置第四周期ⅦA族;丁元素的阴离子结构示意图为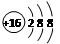 ;(3)反应(I)的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;(4)反应(II)中溴单质可以将正四价的硫氧化为正六价的硫酸,离子方程式为:SO2+Br2+2H2O=4H+
+ SO42— + 2Br—;(5)氢氧化钠与二氧化反应,2:1时,产物是碳酸钠、1:1时,产物是碳酸氢钠,1mol 氢氧化钠的溶液中缓慢通入15.68 L 的CO2时,两种产物都有。根据钠原子守恒可得:2n(Na2CO3)+n(NaHCO3)=1,根据碳原子守恒可得: n(Na2CO3)+n(NaHCO3)=0.7,联立可得:n(Na2CO3)=0.3 mol,n(NaHCO3)=0.4 mol,物质的量之比为3:4。
;(3)反应(I)的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;(4)反应(II)中溴单质可以将正四价的硫氧化为正六价的硫酸,离子方程式为:SO2+Br2+2H2O=4H+
+ SO42— + 2Br—;(5)氢氧化钠与二氧化反应,2:1时,产物是碳酸钠、1:1时,产物是碳酸氢钠,1mol 氢氧化钠的溶液中缓慢通入15.68 L 的CO2时,两种产物都有。根据钠原子守恒可得:2n(Na2CO3)+n(NaHCO3)=1,根据碳原子守恒可得: n(Na2CO3)+n(NaHCO3)=0.7,联立可得:n(Na2CO3)=0.3 mol,n(NaHCO3)=0.4 mol,物质的量之比为3:4。
考点:考查元素推断。

 天天练口算系列答案
天天练口算系列答案 已知甲、乙、丙、丁四种短周期元素在周期表中的位置如图所示,则下列说法中不正确的是( )
已知甲、乙、丙、丁四种短周期元素在周期表中的位置如图所示,则下列说法中不正确的是( )

