题目内容
10.工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁(氯化铁遇水能反应);向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行试验.
回答下列问题:
(1)检验该装置气密性的方法关闭分液漏斗的活塞,D总导气管插入水中,用酒精灯微热烧瓶,D中导气管口有气泡冒出,停止加热后,导气管内有一段上升的水柱,证明装置的气密性良好
(2)制取无水氯化铁的实验中,A中反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
①该反应的氧化剂为MnO2,氧化产物为Cl2;HCl的作用为酸性和还原性.
②该装置制取氯化铁时,存在两点明显缺陷,你的改进方法是在A和B之间加一个装有饱和食盐水的洗气瓶;在C和D之间加一个盛有浓硫酸的洗气瓶.
③装置D中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(3)制取无水氯化亚铁的实验中,装置A用来制取HCl.若仍用D的装置进行尾气处理,存在的问题是发生倒吸、可燃性气体氢气不能被吸收.
分析 (1)依据装置中气体压强变化来判断气密性;
(2)①分析反应中元素化合价变化,所含元素化合价降低的反应物为氧化剂;所含元素化合价升高的元素,为还原剂,还原剂对应氧化产物,依据氯元素在反应中化合价变化判断盐酸的性质;
②依据浓盐酸易挥发,制取的氯气中含有氯化氢,应先除去氯气中氯化氢;依据无水氯化铁(氯化铁遇水能反应),应设置干燥装置,防止D中的水蒸气进入C;
③氯气与NaOH溶液反应生成NaCl、NaClO和水;
(3)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,据此解答即可.
解答 解:(1)检验该装置气密性的方法:关闭分液漏斗的活塞,D总导气管插入水中,用酒精灯微热烧瓶,D中导气管口有气泡冒出,停止加热后,导气管内有一段上升的水柱,证明装置的气密性良好;
故答案为:关闭分液漏斗的活塞,D总导气管插入水中,用酒精灯微热烧瓶,D中导气管口有气泡冒出,停止加热后,导气管内有一段上升的水柱,证明装置的气密性良好;
(2)①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,反应中二氧化锰中的锰元素化合价降低,所以二氧化锰为氧化剂,氯化氢中氯元素部分化合价升高到氯气中的0价,部分氯元素化合价不变,所以盐酸在反应中表现为酸性和还原性,对应产物氯气为氧化产物;
故答案为:MnO2;Cl2;酸性和还原性;
②浓盐酸易挥发,制取的氯气中含有氯化氢,应先除去氯气中氯化氢,所以应在A和B之间加一个装有饱和食盐水的洗气瓶除去氯化氢;
无水氯化铁(氯化铁遇水能反应),防止D中的水蒸气进入C,应在C和D之间加一个盛有浓硫酸的洗气瓶;
故答案为:在A和B之间加一个装有饱和食盐水的洗气瓶;在C和D之间加一个盛有浓硫酸的洗气瓶;
③氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
(3)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,
故答案为:HCl;发生倒吸;可燃性气体H2不能被吸收.
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法,明确氯气制备原理和性质是解题关键,题目难度中等.

①金刚石与“足球烯”C60
②D与T
③16O、17O和18O
④氧气(O2)与臭氧(O3)
⑤CH4和CH3CH2CH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑦
 和
和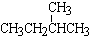
⑧
 和
和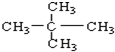
| A. | ①④ | B. | ⑤⑦ | C. | ⑥⑧ | D. | ②③ |
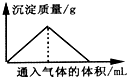
| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向Na[Al(OH)4]溶液中通入HCl气体至过量 |

回答下列问题:
(1)操作A是蒸发结晶(填实验基本操作名称).要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是b.
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是c(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)操作C是热空气吹出;上图中虚线框内流程的主要作用是富集Br2.
(4)图中虚线框内流程也可用
 替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2(5)已知苦卤的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
| A. | 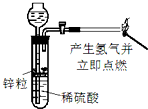 制备并检验氢气的可燃性 | B. | 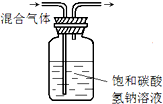 除去CO2中的HCl | ||
| C. | 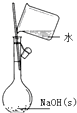 配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
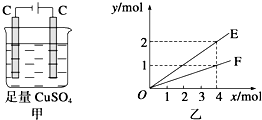
| A. | F表示反应生成Cu的物质的量 | B. | E表示反应生成O2的物质的量 | ||
| C. | E表示反应实际消耗H2O的物质的量 | D. | F表示反应生成H2SO4的物质的量 |
| A. | 向沸腾的NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 加热除去碳酸氢钠中少量氯化铵 | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中,观察过氧化钠的颜色 | |
| D. | 用排四氯化碳法收集氨气、氯化氢 |
| A. | 物质的量 | B. | 原子总数 | C. | 碳原子数 | D. | 分子数 |