题目内容
15.氧化钠是碱性氧化物的原因是( )| A. | 溶于水得到相对应的碱 | B. | 它对应的水合物是可溶于性强碱 | ||
| C. | 它与强酸溶液反应只生成盐和水 | D. | 它是金属氧化物 |
分析 碱性氧化物是能和酸反应生成盐和水的氧化物,金属氧化物大多数是碱性氧化物.据此分析.
解答 解:A、碱性氧化物是能和酸反应生成盐和水的氧化物,不一定溶于水得到对应的碱,故A错误;
B、碱性氧化物是能和酸反应生成盐和水的氧化物,它对应的水合物是可溶于性,如氧化铜,故B错误;
C、碱性氧化物是能和酸反应生成盐和水的氧化物,故C正确;
D、金属氧化物不一定都是碱性氧化物,如氧化铝等,故D错误.
故选C.
点评 本题考查学生碱性氧化物的概念和内涵,注意金属氧化物和碱性氧化物之间的关系是关键,难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1g H2所含分子数为NA | |
| B. | 2g D2O中所含的质子数为NA | |
| C. | 0.5 mol/L Na2SO4溶液中所含Na+ 数为NA | |
| D. | 标准状况下,4.48 L CCl4所含原子数为NA |
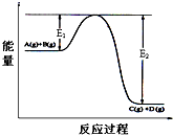
6.CO和H2在ThNi5作用下可以合成CH4.
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
| A. | 催化剂不能改变该反应的△H | |
| B. | ①中反应物的键能总和小于生成物的键能总和 | |
| C. | ②中反应物的总能量高于生成物的总能量 | |
| D. | CO(g)与H2(g)合成CH4(g)的反应为放热反应 |
3.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA个氢离子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA个OH- | |
| C. | 8.4gNaHCO3固体中含有0.1NA 个CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水电离出的H+的数目为10-3NA |
7.T1温度下,体积为2L的恒容密闭容器,加入4.00molX、2.00molY,发生化学反应2X(g)+Y(g)?3M(g)+N(s).部分实验数据如表格所示:
反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |

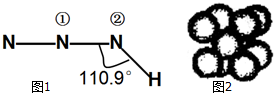 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题: