题目内容
4.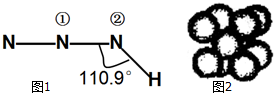 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:(1)下列说法正确的是CDE(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
E.叠氮酸HN3的结构式中①号、②号N的杂化方式分别为sp和sp2
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显+3价,基态Fe原子有4个未成对电子.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是BC(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N${\;}_{3}^{-}$互为等电子体的分子有:CO2、BeCl2(写出两种),其中心原子的孤电子对数为0.
分析 (1)A、HNO2为弱酸,而HNO3是强酸;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化;
C、HN3、H2O中都有孤电子对,所以都是极性分子;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键;
E、叠氮酸HN3的结构式中①号N为直线形、②号N为V型,据此判断;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,根据Fe原子的核外电子排布式确定未成对电子数;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2;
C、氮原子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧;
D、氮气常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关.
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出等电子体的分子.
解答 解:(1)A、HNO2为弱酸,而HNO3是强酸,故A错误;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C、HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
E、叠氮酸HN3的结构式中①号N直线形则为sp、②号N为V型,则杂化方式sp2,故E正确;
故答案为:CDE;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子;
故答案为:+3;4;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故A错误;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2,故B正确;
C、子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D、常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故选:BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为CO2、BeCl2等,其中心原子的孤电子对数为0;
故答案为:CO2;BeCl2;0.
点评 本题考查了学生对原子的杂化方式、分子的空间结构、等电子体、电子式等,具有一定的综合性,对学生综合能力有一定的要求,中等难度.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案| A. | 溶于水得到相对应的碱 | B. | 它对应的水合物是可溶于性强碱 | ||
| C. | 它与强酸溶液反应只生成盐和水 | D. | 它是金属氧化物 |
(1)已知某温度下某反应的化学平衡常数表达式为:K=$\frac{c({H}_{2}O)}{c(CO)•c({H}_{2})}$,所对应的化学反应方程式为:CO(g)+H2(g)?C(s)+H2O(g).
(2)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b)kJ/mol(用含a、b的代数式表示).
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图1所示:

对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(CO{\;}_{2})P(H{\;}_{2})}{P(CO)P(H{\;}_{2}O)}$,提高p[H2O(g)]/p(CO)比,则Kp不变(填“变大”、“变小”或“不变”).实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、p[H2O(g)]/p(CO)=3~5.其原因可能是投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右.
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如图2所示,请写出负极的电极反应式:CO-2e-+CO32-=2CO2.
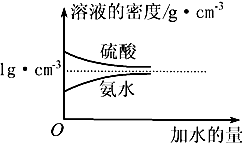 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等质量混合,所得溶液的质量分数为$\frac{{w}_{1}}{2}$,物质的量浓度大于 c1/2mol•L-1(填“大于”、“小于”或“等于”,下同).
(3)质量分数为w2的氨水与3w2的氨水等质量混合,所得溶液的密度小于ρ2 g•cm-3.
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
| A. | NaHCO3溶液的电离:NaHCO3═Na++HCO3- | |
| B. | 氯化铵溶液的水解:NH4++H2O═NH3•H2O+H+ | |
| C. | 碳酸钠的水解:CO32-+2H2O═H2CO3+2OH- | |
| D. | 氯化铝和碳酸钠溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2 |
 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.