题目内容
(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(2)H、D、T三种原子,在标准状况下,1 mol各单质中,它们的质子数之比是 ,
(3)含6.02×1023个中子的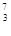 Li的质量是 g。
Li的质量是 g。
(2)H、D、T三种原子,在标准状况下,1 mol各单质中,它们的质子数之比是 ,
(3)含6.02×1023个中子的
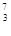 Li的质量是 g。
Li的质量是 g。(1) 1.12 L 2分 0、1 mol 2分 (2)1:1:1 2分
(3)1.75 g 3分
(3)1.75 g 3分
(1)考查原电池的有关计算。由于锌的金属性强于铜的,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,电极反应式分别是负极:Zn-2e-=Zn2+、正极:2H++2e-=H2↑。消耗锌是 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。
,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。
(2)H、D、T三种原子互为同位素,所以质子数是相同的,即单质分子中质子数之比是1︰1︰1。
(1)根据 可知,6.02×1023个中子是1mol,又因为
可知,6.02×1023个中子是1mol,又因为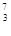 Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。
Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。
 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。
,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。(2)H、D、T三种原子互为同位素,所以质子数是相同的,即单质分子中质子数之比是1︰1︰1。
(1)根据
 可知,6.02×1023个中子是1mol,又因为
可知,6.02×1023个中子是1mol,又因为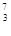 Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。
Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。
练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
 -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )