题目内容
14.下列实验操作中错误的是( )| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干,得到晶体 | |
| D. | 称量时,称量物置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
分析 A.分液时,避免上下层液体混合;
B.蒸馏时,温度计测定馏分的温度;
C.蒸发时,出现大量固体时停止加热,利用余热加热;
D.称量时,遵循左物右码.
解答 解:A.分液时,避免上下层液体混合,则分液漏斗下层液体从下口放出,上层液体从上口倒出,故A正确;
B.蒸馏时,温度计测定馏分的温度,则使温度计水银球靠近蒸馏烧瓶支管口,故B正确;
C.蒸发时,出现大量固体时停止加热,利用余热加热,则不能将溶液蒸干,故C错误;
D.称量时,遵循左物右码,即称量物置于托盘天平的左盘,砝码放在托盘天平的右盘中,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
12.已知Na、Mg、Al为第三周期原子序数递增的元素,则下列说法正确的是( )
| A. | 金属活泼性:Na<Mg<Al | B. | 碱性:NaOH>Al(OH)3>Mg(OH)2 | ||
| C. | 原子半径:Na<Mg<Al | D. | 与水反应的剧烈程度:Na>Mg>Al |
13.半导体工业用石英砂作原料通过三个重要反应生产单质硅.
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
| A. | 24372.86 kJ | B. | 21.44 kJ | C. | 600.20 kJ | D. | 21435.71 kJ |
9. 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液(用化学式表示).
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 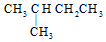 与 与 |
3.将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
| A. | ①⑤⑥④ | B. | ⑧②⑥⑤ | C. | ③⑦⑥⑤ | D. | ④②⑤① |
4.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
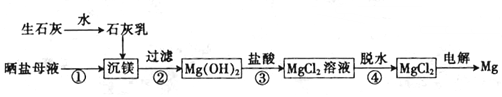
下列说法错误的是( )

下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
