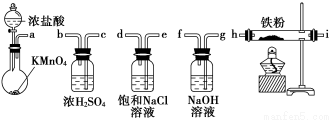
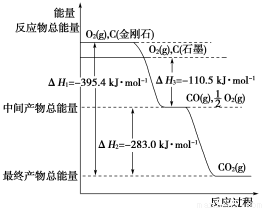
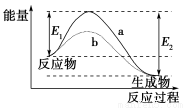
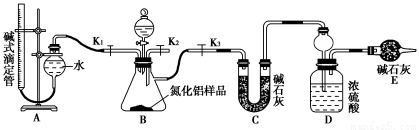
题目内容
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。
已知:H2(g)+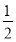 O2(g)=H2O(l)
O2(g)=H2O(l)
ΔH1=-285.8 kJ·mol-1①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②
O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1④
下列说法正确的是( )
A.上述四个反应都是吸热反应
B.1 mol液态H2的能量大于1 mol气态H2的能量
C.H2的燃烧热ΔH为-285.8 kJ·mol-1
D.火箭中液氢燃烧的热化学方程式为H2(l)+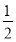 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1
C
【解析】 四个过程的ΔH都小于0,均为放热过程,A项错;H2(g)=H2(l)为放热过程,可知1 mol液态H2的能量小于1 mol气态H2的能量,B项错;由盖斯定律计算D项中的ΔH=-237.46 kJ·mol-1,D项错误。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
时间/min | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 | v(正)和v(逆)比较 |
t0 | 6 | 0 | ? |
t1 | 3 | 1 | v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等