题目内容
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
(1)c2<c1<c3或c3>c1>c2
(2)V1=V2<V3
(3)n1=n3>n2
(4)v1=v2=v3 va=vb<vc
(2)V1=V2<V3
(3)n1=n3>n2
(4)v1=v2=v3 va=vb<vc
盐酸是一元强酸,硫酸是二元强酸,醋酸是弱酸。由于醋酸中存在电离平衡,pH相同时,醋酸的物质的量浓度最大。同样原因,稀释时,促进了醋酸的电离,所需要的水比强酸多。

练习册系列答案
相关题目
 减小
减小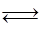 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( ) 2H++S
2H++S H++A2-。回答以下问题:
H++A2-。回答以下问题: HCN+NaNO2,NaCN+HF
HCN+NaNO2,NaCN+HF