题目内容
某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
 H++A2-。回答以下问题:
H++A2-。回答以下问题:(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
| A.c(H+)·c(OH-)=1×10-14 mol·L-1 |
| B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) |
| D.c(Na+)+c(K+)=0.05 mol·L-1 |
(1)显酸性 HA-只电离不水解 (2)BC
(1)由题给电离方程式知:HA-只电离不水解,所以NaHA溶液显酸性。(2)溶液显中性,则c(H+)=c(OH-),根据电荷守恒有:c(H+)+c(Na+)+c(K+)=c(OH-)+c(HA-)+2c(A2-),则c(Na+)+c(K+)=c(HA-)+2c(A2-);加入KOH溶液,发生反应HA-+OH-=A2-+H2O,A2-水解使溶液显碱性,所以,加入的KOH的物质的量小于NaHA的物质的量,c(Na+)>c(K+)。

练习册系列答案
相关题目
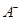 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。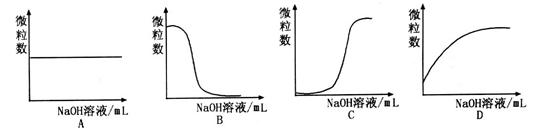
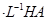 溶液和1体积0.02mol
溶液和1体积0.02mol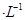 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。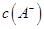 0.01 mol
0.01 mol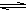 CH3COO- + H3O+
CH3COO- + H3O+